如果您喜欢CROU制药在线推送的这篇文章
欢迎点赞和转发哦~
【线上】2022基于化学创新药案例的药物分析人员关键岗位技能提升专题培训班
【线上】2022跨越基层-cGMP框架下制药企业储备生产负责人能力提升研修班
【线上】2022 MAH制度下CMO/CDMO企业如何做好药品研发生产的质量保障、安全及监管合规要求高级研修班
【线上】2022制药企业质量保证实施策略解析和案例分析-暨质量QA管理人员技能专项提升高级研修班
【线上】2022符合FDA和欧盟法规要求的cGMP文件和记录系统要求及检查实践专题研修班
【线上】基于药品生命周期管理的全员确认与验证实施策略解析专题研修班
【线上】GMP管理体系的搭建改善及变更、偏差实施策略解析高级研修班
【线上】符合ICH指导原则的质量标准建立与分析方法策略实施高级研修班
↑点击以上链接即可跳转培训内容界面
来源:中国药事
作者:薛晶,黄宝斌,张炜敏
国家食品药品检定研究院,北京
本次阅读的文献是来自于中国食品药品检定研究院的薛晶于2022年10月发表在《中国药事》上的《结合药品注册检验受理常见问题解读与之相关章节》。
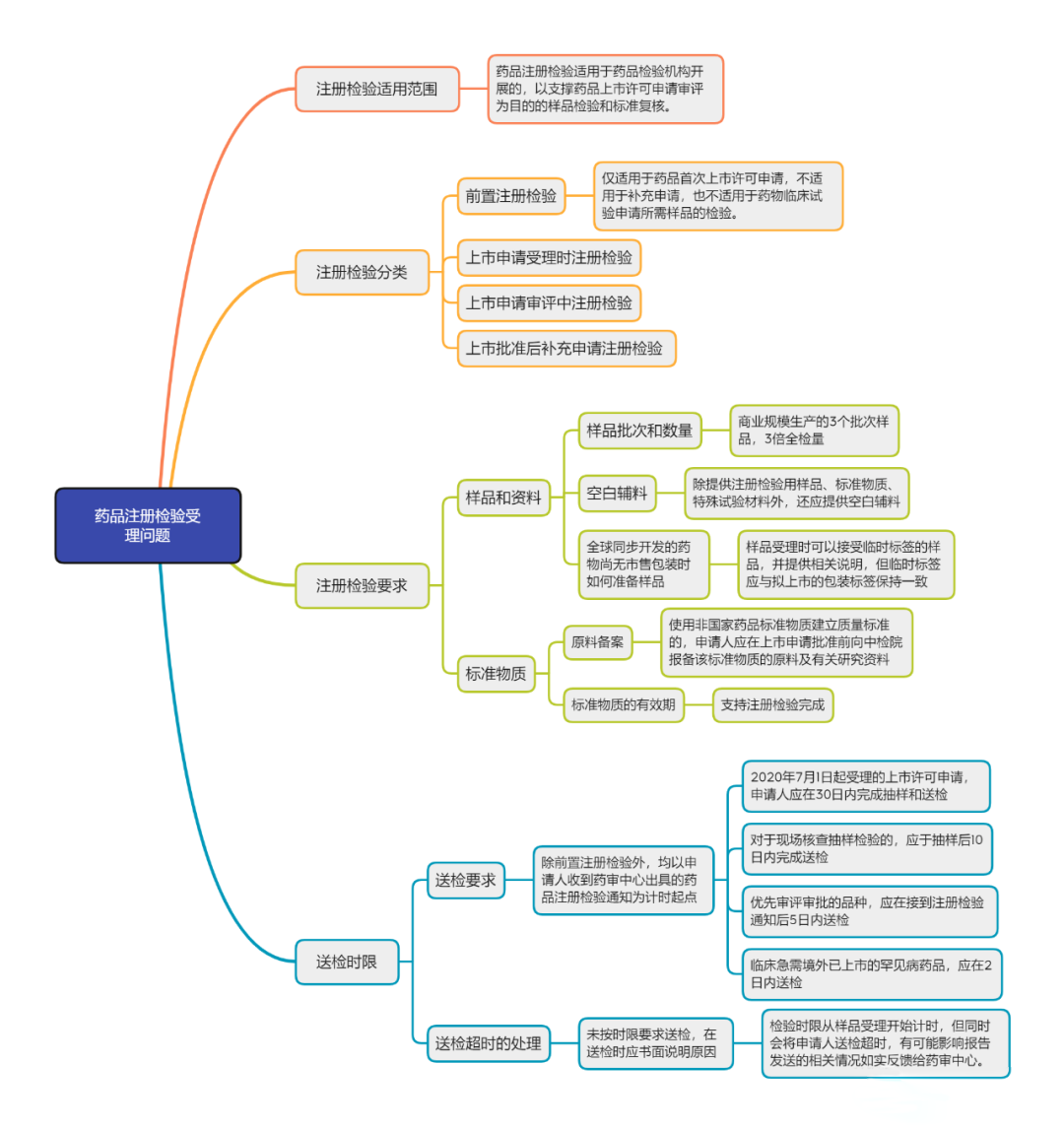
从多个方面结合受理常见问题对有关规定和要求进行解读,对药品注册检验相关规章在实施细则和技术要求上有待完善之处进行探讨并提出修订思路,受理常见问题主要涉及注册检验适用范围、注册检验分类、注册检验要求、送检时限、样品受理、二次检验等方面,反映出药品注册申请人对药品注册检验相关规章的理解和领悟需要加强。
先来一图get注册检验受理常见问题:
注册检验适用范围 《药品注册检验工作程序和技术要求规范》已明确,药品注册检验适用于药品检验机构开展的,以支撑药品上市许可申请审评为目的的样品检验和标准复核。对于申请人为报送化学仿制药一致性评价申请而向药品检验机构提出的复核检验,按照《关于仿制药质量和疗效一致性评价工作有关事项的公告》(2017年第100号)[4]的要求,检验性质属于委托检验,与注册检验的性质不同。
注册检验分类 《规范》依据药品注册检验的启动主体和药品注册阶段的不同,将药品注册检验分为前置注册检验、上市申请受理时注册检验、上市申请审评中注册检验和上市批准后补充申请注册检验四种类别。
《办法》允许注册检验于药品上市许可申请受理前进行,谓之“前置注册检验”;并将原药品注册程序中的审评、核查、检验三个串联环节调整为并联,即审评、核查、检验同步开展,谓之“上市申请受理时注册检验”。“前置注册检验”和“上市申请受理时注册检验”的提出,是《办法》在药品注册管理方式上的创新之举,进一步优化了药品审评审批工作程序。
注册检验要求 《规范》要求,注册检验所需样品应当为商业规模生产的3个批次(罕见病药品除外)样品,每批样品的数量应当为质量标准全项或单项复核检验所需量的3倍。《启动工作程序》第三十四条补充要求,除特殊情形外,生物制品原则上应为连续生产的3批样品,中药和化学药品无此要求;开展动态生产现场核查的品种,应抽取动态生产样品。样品数量不足时,申请人将自行承担可能无法完成所有检验项目的风险。
送检时限 对送检时限的要求因上市申请受理时间、审评时限、注册检验类型的不同而有所差别,除前置注册检验外,均以申请人收到药审中心出具的药品注册检验通知为计时起点。
《规范》要求,自2020年7月1日起受理的上市许可申请,申请人应在30日内完成抽样和送检;对于现场核查抽样检验的,应于抽样后10日内完成送检;对于优先审评审批的品种,应在接到注册检验通知后5日内送检,其中临床急需境外已上市的罕见病药品,应在2日内送检。有数据显示,目前申请人的按时送检率较低。以中检院为例,申请人能够在30日内完成抽样和送检的尚不足40%,说明申请人在提出上市申请前的准备工作并不充分,由于自身原因延长了审评周期。
原文如下:
近期培训课程
地点 时间 (点击↓链接阅读全文) 线上 11月26-27日 【线上】2022基于化学创新药案例的药物分析人员关键岗位技能提升专题培训班 线上 11月26-27日 【线上】2022跨越基层-cGMP框架下制药企业储备生产负责人能力提升研修班 线上 11月26-27日 【线上】2022污染控制策略(CCS)与无菌药品微生物控制策略和无菌保障应用高级研修班 线上 12月17-18日 【线上】2022 MAH制度下CMO/CDMO企业如何做好药品研发生产的质量保障、安全及监管合规要求高级研修班 线上 12月17-18日 【线上】2022制药企业质量保证实施策略解析和案例分析-暨质量QA管理人员技能专项提升高级研修班 线上 12月17-18日 【线上】符合ICH指导原则的质量标准建立与分析方法策略实施高级研修班 线上 12月17-18日 【线上】制药实验室运营管理及实验室信息化建设高级研修班 线上 12月23-24日 【线上】2022新药临床前安全性评价实操专题培训班 线上 12月24-25日 【线上】2022符合FDA和欧盟法规要求的cGMP文件和记录系统要求及检查实践专题研修班 线上 12月24-25日 【线上】2022最新细胞治疗产品GMP指南落地实施专题培训班 线上 12月24-25日 【线上】药品研发质量管理体系构建与执行及项目管理实例分享交流会 线上 12月29-30日 【线上】生物新药研发与注册项目管理的合规体系建立、执行关键点解析高级研修班 线上 12月29-30日 【线上】基于药品生命周期管理的全员确认与验证实施策略解析专题研修班 线上 1月07-08日 【线上】GMP管理体系的搭建改善及变更、偏差实施策略解析高级研修班

长按二维码关注我们



 个人中心
个人中心
 我是园区
我是园区