
离子作为细胞内外环境的重要因素,其稳态平衡在维持免疫细胞功能方面有着重要作用。二价离子例如Ca2+作为重要的第二信使直接参与免疫相关信号通路的调控。一价离子例如K+则可以通过影响细胞膜电势
(Vm)
进而调控二价离子的流动以及相关信号通路。
肿瘤微环境
(tumor microenvironment,
TME
)
作为一种独特的生态位
(niche)
,其稳态受到了肿瘤内各种细胞和胞外成分调控
【1】
。以往的研究表明,这种以营养失衡、缺氧以及酸性为特征肿瘤微环境,对于肿瘤免疫细胞功能影响巨大。肿瘤微环境中的生物和无机因素的共同作用对于肿瘤内免疫细胞的适应性和功能塑造不可或缺。从肿瘤-免疫共同进化的角度,了解瘤内免疫细胞对抗或妥协这种严酷微环境中所采用的策略,可以为研究肿瘤诱导的免疫抑制背后的机制带来新的见解。近年来,一系列研究表明肿瘤内的也存在离子稳态失衡情况,且离子稳态对于肿瘤内免疫细胞的功能也至关重要
【2,3】
。其中高钾离子(high K+)是其中一种广泛存在的微环境特征。虽然目前的研究阐明了肿瘤内高钾对肿瘤浸润效应性T细胞的免疫抑制作用
【2】
,关于这种泛癌特征对肿瘤内固有免疫的影响还未被报道。
2022年9月13日,浙江大学医学院王迪教授联合浙江大学医学院附属第二医院丁克峰教授团队在Cell Metabolism杂志发表了题为
Tumor-associated macrophages are shaped by intratumoral high potassium via Kir2.1
的研究论文。该研究
同时在小鼠模型和人类样本中,证明肿瘤内高K+通过靶向内向整流K+通道Kir2.1,调节
肿瘤相关巨噬细胞
(tumor-associated macrophages,
TAM
)
的功能极化,从而抑制其抗肿瘤能力。

肿瘤相关巨噬细胞
(TAM)
是一类肿瘤内动态且高异质性的细胞群,其异质性反映了其在肿瘤进展和临床预后上的双重作用:它们不仅可以发挥杀肿瘤功能、诱导抗肿瘤反应,也能促进肿瘤免疫逃逸和免疫抵抗。在营养缺乏的TME中,TAM的功能状态受到了很大的影响,其细胞代谢编程和对外源营养物的偏好
(metabolic preference)
之间的内在联系仍不明确。
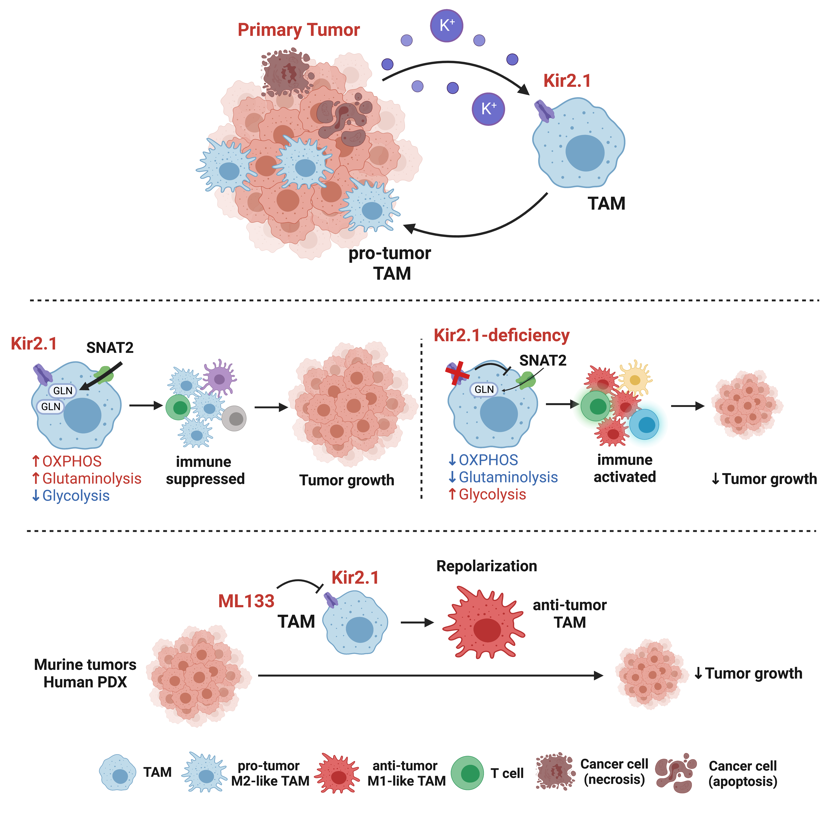
研究人员利用多种小鼠肿瘤模型以及人临床肿瘤样本,发现肿瘤内高K+显示出对TAM抗肿瘤极化
(anti-tumor)
的抑制作用。作者进一步利用RNA-seq和膜片钳技术,鉴定了内向整流K+通道
Kir2.1
作为TAM感知高K+ TME并发生极化的重要调控分子。Kir2.1的条件性敲除能够解除高K+对TAM的抑制作用,使TAM复极化以重新获得抗肿瘤作用,降低肿瘤负荷。通过流式细胞仪和单细胞分析,研究人员系统地描绘了Kir2.1巨噬细胞条件性敲除可以全局性重塑TME中免疫细胞的抗肿瘤功能。
机制研究上,研究人员发现Kir2.1敲除可以使得TAM从氧化磷酸化
(oxidative phosphorylation, Oxphos)
为优势的代谢特征转化为糖酵解
(glycolysis)
模式。功能代谢分析揭示了Kir2.1在TAM的代谢偏好性中发挥重要作用,Kir2.1维持的巨噬细胞膜电势对于电化学依赖的谷氨酰胺
(glutamine)
转运体SNAT2的功能至关重要。
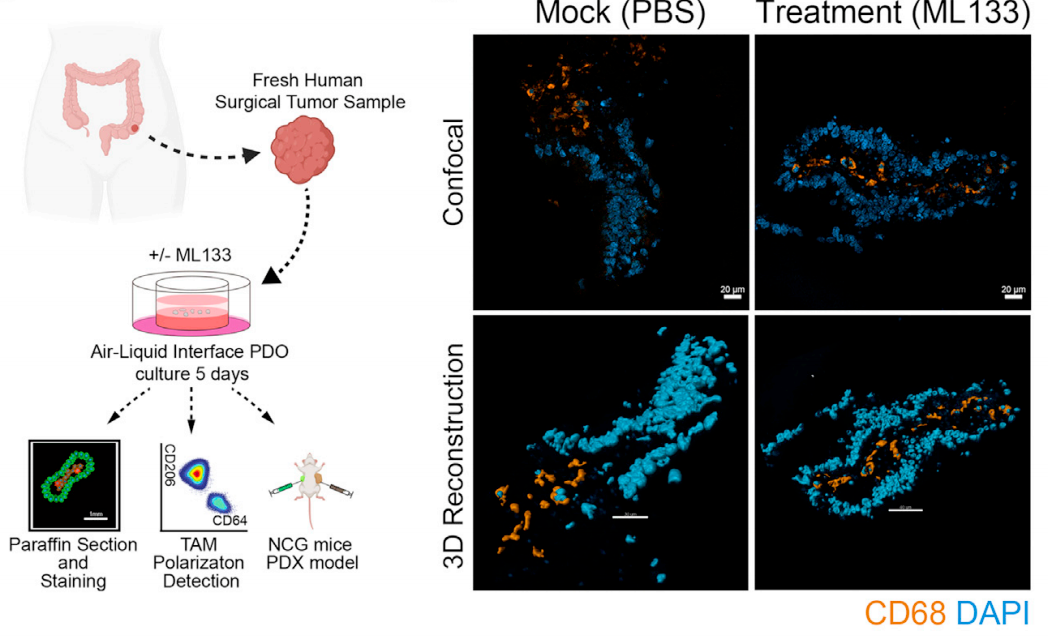
为了进一步探索Kir2.1与肿瘤预后的关联性,研究人员在一个单中心回顾性队列中发现TAM Kir2.1的表达水平与结直肠癌患者临床结果的相关性。同时,通过单细胞数据分析得出的Kir2.1 high TAM的特征基因也可以区分TCGA泛癌患者的生存期。最后,作者使用Kir2.1的选择性抑制剂ML133来评估药理学靶向Kir2.1的治疗潜力。在小鼠模型中,ML133与PD-1单抗的联合利用达到了更好的治疗效果。并且,ML133在小鼠移植肿瘤和结直肠癌患者来源的类器官
(patient-derived organoid, PDO)
中均显示出重编程TAM的巨大潜力,并可以抑制了小鼠和人源肿瘤的生长。在体外PDO模型中,ML133治疗将所有5名患者的人源性TAM复极化为抗肿瘤的M1状态,平均响应率为72.14%。
综上,
这项研究确定了在离子紊乱的肿瘤微环境中,Kir2.1作为TAM极化的关键调控分子。Kir2.1通过代谢重编程调节TAM的极化,从而影响其免疫功能。这些发现显示Kir2.1能够作为重塑TAM抗肿瘤能力的潜在靶点,也拓宽了人们对肿瘤微环境中离子紊乱的认识。
浙江大学医学院免疫学系王迪教授和浙江大学医学院附属第二医院大肠外科丁克峰教授为本文通讯作者,八年制博士研究生陈晟和崔文羽博士为论文共同第一作者。该研究得到了浙江大学钱俊斌教授、杨巍教授等课题组的帮助。
同期,王迪教授联合浙江大学医学院生物物理系杨巍教授团队,对Kir2.1对巨噬细胞在炎症过程中的功能也做了系统性研究,在Nature Communications杂志发表标题为
Kir2.1-mediated membrane potential promotes nutrient acquisition and inflammation through regulation of nutrient transporters
的研究文章,
发现了巨噬细胞在炎症反应期间对于外部营养物质的获取受到了细胞膜电势
(membrane potential, Vm)
的精密调控。
研究人员发现巨噬细胞膜表面的离子通道Kir2.1负责维持巨噬细胞炎症期间的膜电势稳定,而Kir2.1失活则会导致细胞膜电势发生去极化
(depolarization)
,进而导致细胞膜磷脂的稳态改变,导致细胞膜上一些重要营养转运通道的内化
(internalization)
加剧,使巨噬细胞在炎症期间缺少必要的外部营养补给,最终造成其炎症功能受到抑制。

为了更全面理解离子环境对炎症性巨噬细胞功能的影响,该研究通过运用大量的膜片钳实验技术,证实了Kir2.1在炎症性巨噬细胞膜电势维持中的关键作用。通过转录组测序和非靶向代谢组分析,研究人员发现当细胞膜电势发生去极化后,巨噬细胞应对细菌的炎症反应会大幅度下降,而且去极化会引起巨噬细胞产生营养物质不足的现象。研究人员进一步发现,去极化的炎症性巨噬细胞表面的营养转运通道表达下降,原因是膜电势紊乱导致细胞膜磷脂的动态改变加剧了营养转运通道内化作用的发生,造成了炎症性巨噬细胞出现饥饿应答现象。在炎症反应期间,一旦巨噬细胞的营养获取不足,启动炎症基因表达的表观遗传修饰原材料
(如甲基化供体SAM)
无法得到充足的供应,最终导致巨噬细胞炎症的削弱。
浙江大学医学院免疫学系王迪教授和生物物理系杨巍教授为本文通讯作者,余伟伟博士、王振博士、余夏飞博士为论文共同第一作者。王迪教授团队长期从事肿瘤微环境和损伤修复过程中的免疫代谢以及不同类型细胞间的代谢通讯研究,课题组长期诚招具有良好学术背景,具有生信分析经验的博士后加入。
简历投递(有意者请将个人简历等材料发至):
https://jinshuju.net/f/ZqXwZt或扫描二维码投递简历

原文链接:
https://doi.org/10.1016/j.cmet.2022.08.016
https://www.nature.com/articles/s41467-022-31149-y
[1] Kaymak I, et al. Immunometabolic Interplay in the Tumor Microenvironment. Cancer Cell. 2021 Jan 11;39(1):28-37. doi: 10.1016/j.ccell.2020.09.004. Epub 2020 Oct 29. PMID: 33125860; PMCID: PMC7837268.
[2] Eil R, et al. Ionic immune suppression within the tumour microenvironment limits T cell effector function. Nature. 2016 Sep 22;537(7621):539-543. doi: 10.1038/nature19364. Epub 2016 Sep 14. PMID: 27626381; PMCID: PMC5204372.
[4] Lötscher J, et al. Magnesium sensing via LFA-1 regulates CD8+ T cell effector function. Cell. 2022 Feb 17;185(4):585-602.e29. doi: 10.1016/j.cell.2021.12.039. Epub 2022 Jan 19. PMID: 35051368.
【非原创文章】本文著作权归文章作者所有,欢迎个人转发分享,未经作者的允许禁止转载,作者拥有所有法定权利,违者必究。














 个人中心
个人中心
 我是园区
我是园区





