▲点击上方的蓝色“医谷”关注我们
“置顶公众号”获取最有价值行业趋势信息
医谷微信号:yigoonet
日前,医学学术期刊《柳叶刀》预印本平台(Preprints with The LANCET)发表了一篇名为《Immunogenicity and Safety of BNT162b2 mRNA Vaccine in Chinese Adults: A Randomized Clinical Trial》的研究论文,披露了mRNA新冠疫苗BNT162b2(复必泰)中国II期临床试验的主要研究数据,这也是首个披露中国人群二期临床数据的mRNA新冠疫苗。

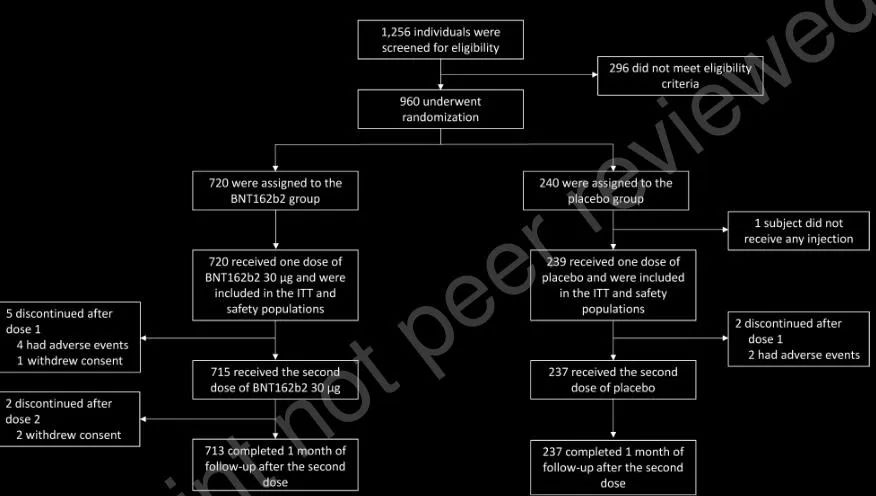
据了解,这项二期临床研究采用了随机、双盲、安慰剂对照的研究设计,由江苏省疾病预防控制中心主导执行,在2020年12月5日至2021年1月9日期间共招募了959例18-85岁受试者,受试者按年龄分为2组(18-55岁和56-85岁),并以3:1的比例随机接种2剂30μg(微克)剂量的mRNA新冠疫苗BNT162b2或安慰剂,其中BNT162b2组720例,安慰剂组239例,2剂间隔时间为21天。
这项试验的主要目的是描述中国健康受试者在BNT162b2预防性疫苗第2剂接种1个月后的体液免疫应答,次要目的包括:观察直至研究结束,中国健康受试者接种BNT162b2的体液免疫应答;在每次接种后7天和14天内,观察间隔21天给予BNT162b2或安慰剂的安全性和耐受性特征;观察直至研究结束,BNT162b2在中国健康受试者中接种的安全性。
试验结果显示,BNT162b2可以诱导强烈的SARS-CoV-2中和抗体和特异性T细胞应答,在活病毒微量中和试验中,所有接种2剂BNT162b2的受试者均显示出较强的中和抗体应答,50%中和抗体GMT为294.4(95%CI;281.1-308.4),而在接种疫苗前,所有接种者均未检测到抗体应答,这项试验中BNT162b2诱导的中和抗体水平与此前开展的两项境外1/2期临床试验结果一致。
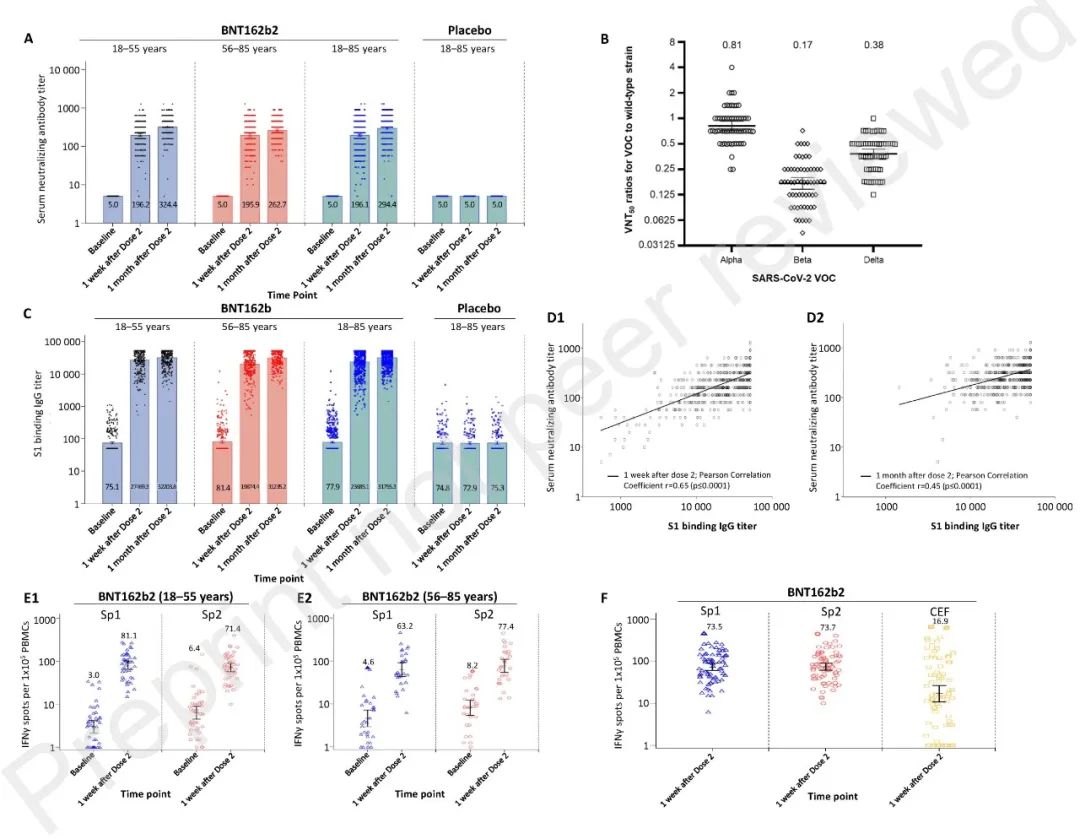
此外,该项试验还开展了针对需要关注的病毒变异株(VOC)的交叉中和试验,试验结果表明,在接种第2剂BNT162b2后1个月,BNT162b2受试者血清均可有效中和Alpha、Beta和Delta变异株,由于临床试验期间奥密克戎变异株尚未出现,该研究没有提供疫苗针对奥密克戎变异株的有效性数据。
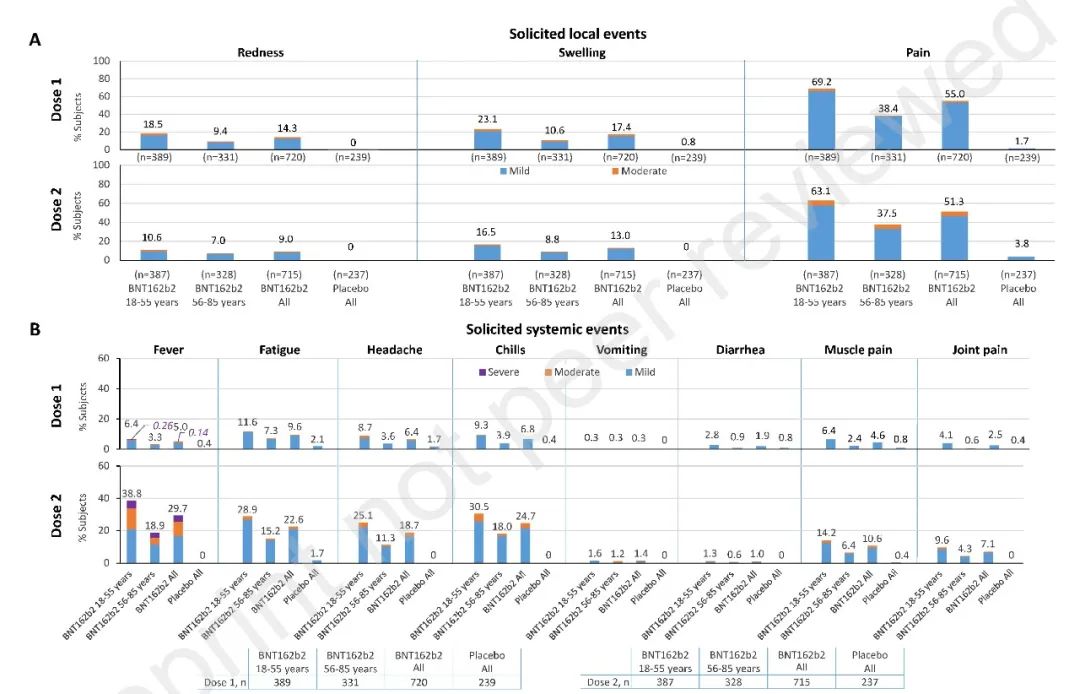
安全性方面,试验要求参与者记录每次注射后14天内任何出现的接种反应,包括发热、发力、头痛、发冷、呕吐、腹泻、肌肉疼痛、关节疼痛以及退热药物的使用情况等。结果显示,几乎所有在7天内发生的接种反应均为轻度或中度,且大部分接种反应是短暂的,其中最常见的局部事件是注射部位疼痛,最常见的全身性事件是发热,试验中没有报告心肌炎、心包炎或过敏反应的病例,疫苗接种后发生严重心脏不良事件的风险很小,未产生不良事件或严重不良事件。
不过,上述研究结果也仍然存在一些局限性,特别是随访时间短(第二剂后一个月),并且缺乏接种疫苗后新冠的发生率及产生后果的数据,研究者表示,该试验参与者的安全性数据收集将持续到第二剂接种后的12个月。
BNT162b2由BioNTech和辉瑞共同研发,于2020年12月获得美国FDA的紧急使用授权,2021年8月,FDA正式批准了BNT162b2的上市,其成为首款获批上市的mRNA新冠核酸疫苗,而早在2020年3月,复星医药已和BioNTech达成合作,通过支付8500万美元许可费与35%的毛利销售提成等合作条款,获得独家负责BNT162b2在中国香港、澳门、台湾及大陆地区的开发及商业化权利。
据复星医药财报显示,复必泰于2021年3月纳入港澳地区政府接种计划,2021年9月在中国台湾地区开展接种截至2022年2月末,港澳台地区已累计接种超2000万剂。在销售业绩方面,复必泰实现销售规模超10亿元,一举成为复星医药三大超10亿营收的龙头产品之一,直接拉动了复星医药抗感染产品线的总体营收翻番。
截止目前,复必泰尚未在中国大陆地区获批,在今年3月召开的以一次业绩交流会上,复星医药董事长兼首席执行官吴以芳表示:“复必泰中国大陆上市还在审批的过程当中,没有什么更多的消息”。
文 | 医谷
推荐阅读
《茅台医院,开业》






 个人中心
个人中心
 我是园区
我是园区




