4月26日至27日,FDA 召开了2022年仿制药论坛(Generic Drugs Forum,GDF),此次会议通过提供实用建议、介绍真实案例研究以及深入分析简化新药申请(ANDA)评估过程,聚焦仿制药的现状,讨论了许多热门话题,如 pre-ANDA 计划、仿制药指标、上市后安全、批准前检查和全球仿制药事务等等。
下文简述了会上讨论的 ANDA 中的常见缺陷以及与数据可靠性相关的问题,完整的会议视频和 PPT 可登录识林观看(视频列表请见文末)。
ANDA 中的常见缺陷
与往年相比,2021财年 FDA 通过其拒绝接收(refuse-to-receive,RTR)机制拒绝的 ANDA 数量较少,这归因于行业透明度的提高、更好的申请实践以及与申请人沟通的加强。
FDA 的努力,识林曾有多次报道,如相关资讯【FDA 发布 ANDA 缓释片生产缺陷评估报告,帮助仿制药申请人规避缺陷提高首轮批准率】。
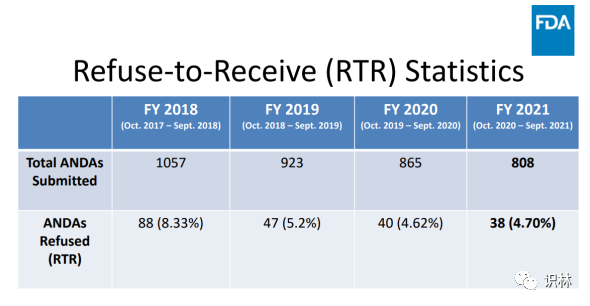
论坛第二天,评审专家 Peter Enos 讨论了行业如何改进文件的提交以避免 RTR。FDA 数据显示,在2021财年,808份 ANDA 申请中有4.7%被拒收,低于2018财年的1057份申请中8.33%的拒收率。2021财年引起 RTR 的主要缺陷为稳定性数据不足以及与参比制剂(reference-listed drug,RLD)定性/定量(Q1/Q2)一致性的研究不充分。其他问题包括溶出度研究不充分、杂质鉴定不充分、生物等效性研究不充分,以及使用某些辅料的理由不充分。
为了确保稳定性数据的可接受性,Enos 表示“每个规格必须提供至少三个试验批次,来自两个批次的 API,且数据应包括需要三个时间点的至少六个月的加速和长期稳定性研究。”如果在加速研究的任何时间点出现稳定性超标,则应进行中间条件稳定性研究(Intermediate studies)。
为了避免定性/定量(Q1/Q2)比较的不充分,申办方应确保非肠道药品(注射剂)包含与 RLD 相同的辅料,浓度也相同。某些辅料(即防腐剂、缓冲剂、抗氧剂)允许与 RLD 有差异,但需标注不同之处,阐述理由,并研究证明上述不同不影响所申请产品的安全性和有效性,但眼用药不得使用与 RLD 不同的辅料。
为确保溶出度研究充分,建议申办者参考 FDA 的特定产品指南(product-specific guidances,PSG,最新的 PSG 指南于2022年2月发布),其中包括溶出度研究建议和其他有关开发特定仿制药的建议。溶出度研究应包括受试产品和 RLD 的每种规格至少12个剂量单位。
此外,电子通用技术文档 (eCTD) 中的提交内容应清晰易读,页面导航应正确,提交内容应包含足够的描述性书签或超链接。
ANDA 中的数据可靠性问题
在为期两天的仿制药论坛上有七个关于数据可靠性(Data integrity,DI)的单独演讲,占据了论坛第一天几乎一半的时间,也提示了 DI 问题在行业中仍然存在并且十分重要,而 FDA 再次将重点转向识别和解决 DI 带来的问题。
仿制药办公室(OGD)副主任 Nilufer Tampal 指出,质量文化(Culture of Quality)薄弱的公司更容易提交存在数据可靠性问题的 ANDA。她在演讲中强调了与 DI 相关的各种问题,涵盖生物等效性研究、药理学/毒理学研究、临床和分析研究以及 ANDA 中的 DI,并讨论了解决问题的方法以及对 DI 的一些常见误解。
仿制药申请和开发过程中数据可靠性问题可以分为以下四类:
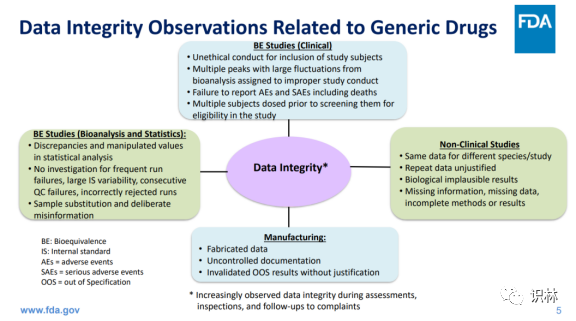
上图内容翻译如下:
生物等效性研究/临床:
招募研究受试者的非伦理行为(Unethical conduct)
由于研究行为不当,生物分析出现多个波动较大的峰
未报告不良事件(AEs)和严重不良事件(SAEs),包括死亡
多个受试者在筛选是否符合研究资格之前服用了药物
BE 研究(生物分析和统计):
统计分析中的差异和操纵值(manipulated values)
没有针对频繁运行故障、内标(Internal standard,IS)可变性、连续 QC 故障、不合理的剔除数据(incorrectly rejected runs)进行调查
样本替换和故意错误信息
非临床研究:
不同物种/研究的相同数据
重复的数据未得到说明
生物学上不合常理的结果
信息缺失、数据缺失、方法或结果不完整
生产:
伪造的数据
不受控的文件记录
无正当理由的无效超标(Out of specification, OOS)结果
对数据可靠性的误解
关于数据可靠性违规的常见误解,一是数据可靠性问题只会出现在质量控制实验室,这是错误的,因为这些问题可能发生在公司的任何地方;另一个误解是领导层对 DI 问题“不负责任、不可能知道”,这也是错误的,解雇一名应对数据可靠性违规负责的员工不能解决问题。
质量文化有“缺陷”的公司更容易受到数据可靠性问题的影响,拥有强大质量文化的公司能够更好地防止 DI 问题的发生。强大的企业质量文化是指“领导层致力于促进支持数据可靠性和产品质量的工作环境,并制定了有关行为标准的详细政策”。公司需要通过持续培训不断强化质量文化,领导层应强调数据质量是每个人的责任,这一点很重要。强大的质量文化鼓励公开透明的沟通,尤其是在错误报告和偏差方面。对质量文化的强调,识林曾有评论文章:【质量对话:质量文化的两项标志】
最后,Tampal概括了数据可靠性审查的关键要点:
FDA 期望在ANDA中提交的所有数据都是可靠和准确的
确保仿制药符合FDA的可互换、高质量药物标准
申请人有责任确保所有其他来源研究活动的数据可靠性
领导层应积极投资于工具和政策,以增强数据可靠性
质量管理体系(Quality Management System, QMS)和企业质量文化不是一劳永逸的事情
下表为此次论坛的所有演讲与讨论,视频内容和相关PPT可至识林查看。
第一天 |
|
|
|
主旨演讲 - OGD 和 OPQ Keynote - OGD & OPQ |
|
|
知识辅助评价和结构化申请 (KASA):药品评价 Knowledge-Aided Assessment and Structured Application (KASA): DRUG PRODUCT ASSESSMENT |
|
|
通过 KASA 实现制造评估现代化 Modernizing Manufacturing Assessment through KASA |
|
|
KASA 在生物药剂学评估中的应用 Use of Knowledge-Aided Assessment and Structured Application (KASA) in Biopharmaceutics Assessment |
|
|
综合质量评估 - 药品 Integrated Quality Assessment - Drug Product |
|
|
问题与小组讨论 Questions & Panel Discussion |
|
|
概述:仿制药计划年度统计 Overview: Generic Drug Program Annual Statistics |
|
|
公共统计数据 - 它们是什么?它们意味着什么? Public Stats - What Are They and What Do They Mean |
|
|
公共统计数据及其含义 - 仿制药政策办公室 Public Stats and What They Mean - Office of Generic Drug Policy |
|
|
ANDA 计划公共统计数据及其含义 - 药品质量办公室 ANDA Program Public Stats and What They Mean - Office of Pharmaceutical Quality |
|
|
问题与小组讨论 Questions & Panel Discussion |
|
|
质量文化 Culture of Quality |
|
|
申请提交中的数据可靠性和数据质量 Data Integrity and Data Quality in Application Submissions |
|
|
BA/BE临床现场检查的数据可靠性问题:案例研究和OSIS评估 Data Integrity Issues from BA/BE Clinical Site Inspections: Case Studies and OSIS Evaluation |
|
|
分析数据可靠性 - 透过现象看本质 Analytical Data Integrity - Looking Beyond the Obvious |
|
|
药理学毒理学研究中的数据可靠性 Data Integrity in Pharmacology Toxicology Studies |
|
|
数据可靠性在药物应用中的作用 Role of Data Integrity in Drug Applications |
|
|
问题与小组讨论 Questions & Panel Discussion |
第二天 |
|
|
|
FDA 关于人用药中亚硝胺杂质的控制概述 FDA Overview Control of Nitrosamine Impurities in Human Drugs |
|
|
液体制剂常见制造相关缺陷 Common Manufacturing Related Deficiencies for Liquid Drug Products |
|
|
问题与小组讨论 Questions & Panel Discussion |
|
|
仿制药开发和全球不同的监管法规 Generic Drug Development and Globally Divergent Regulations |
|
|
FDA 产品特定指南计划概述 FDA Product-Specific Guidance Program Overview |
|
|
使用前瞻性研究支持产品特定指南(PSG)开发的方法 Approaches Using Proactive Research in Support of Product-Specific Guidance (PSG) Development |
|
|
|
|
|
|
|
|
Pre-ANDA 会议计划概述 Overview of Pre-ANDA Meeting Program |
|
|
问题与小组讨论 Questions & Panel Discussion |
|
|
与 FDA 沟通的最佳实践和策略 Best Practices and Strategies for Communication with FDA |
|
|
立卷审查部门:ANDA和受控函提交的最佳实践 Division of Filing Review: Best Practices for ANDAs and Controlled Correspondence Submissions |
|
|
|
|
|
上市前和上市后仿制药安全项目管理 Project Management of Premarket and Postmarket Generic Drug Safety |
|
|
在 ANDA 中进行可比性分析的最佳实践 Best Practices for Conducting Comparative Analyses in ANDAs |
|
|
问题与小组讨论 Questions & Panel Discussion |
|
|
在 COVID-19 大流行期间使用替代工具进行检查 Use of Alternate Tools for Inspections during the COVID-19 Pandemic |
|
|
评估药品质量体系的有效性:质量监督办公室的视角 Assessing the Effectiveness of a Pharmaceutical Quality System: Office of Quality Surveillance Perspective |
|
|
OPQ 政策更新:ICH Q12 OPQ Policy Update: ICH Q12 |
|
|
问题与小组讨论 Questions & Panel Discussion |
作者:识林-红木
长按下方二维码下载识林®App

识林®版权所有,未经许可不得转载。



 个人中心
个人中心
 我是园区
我是园区




