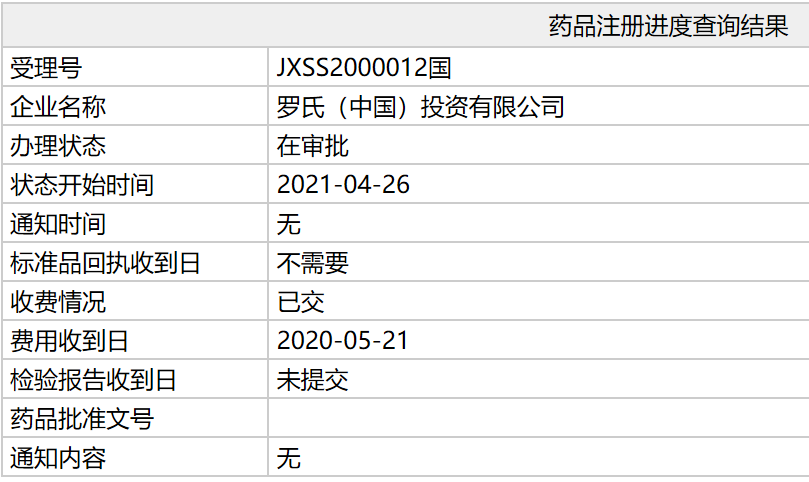
中国国家药监局(NMPA)药品注册进度查询结果显示,罗氏(Roche)提交的艾美赛珠单抗注射液(emicizumab)新适应症上市申请,其办理状态已更新为:在审批,这意味着该新适应症有望近期在中国获批。根据NMPA药品审评中心(CDE)优先审评公示,该申请适应症为:适用于不存在凝血因子VIII抑制物的A型血友病患者。
A型血友病是由于X染色体连锁的凝血因子Ⅷ缺乏、凝血功能异常引起的隐性遗传性出血性疾病。患者血液不能正常凝固,易出现不受控和频繁的持续或自发性出血。目前,许多针对体内不含因子VIII抑制物的A型血友病预防性疗法都需要患者每周进行多次注射。即使注射药物后,患者还是会出现出血情况,他们急需新的疗法来改善治疗和生活。
艾美赛珠单抗是全球血友病治疗领域的一款重磅药,为一款双特异性因子IXa和因子X抗体,它可以将激活天然凝血级联所需的因子IXa和因子X聚集在一起,帮助A型血友病患者恢复凝血功能。
2018年底,艾美赛珠单抗已在中国获批用于
存在
凝血因子Ⅷ抑制物
的A型血友病患者(先天性凝血因子Ⅷ缺乏)的常规预防性治疗,以防止出血或降低出血发生的频率。
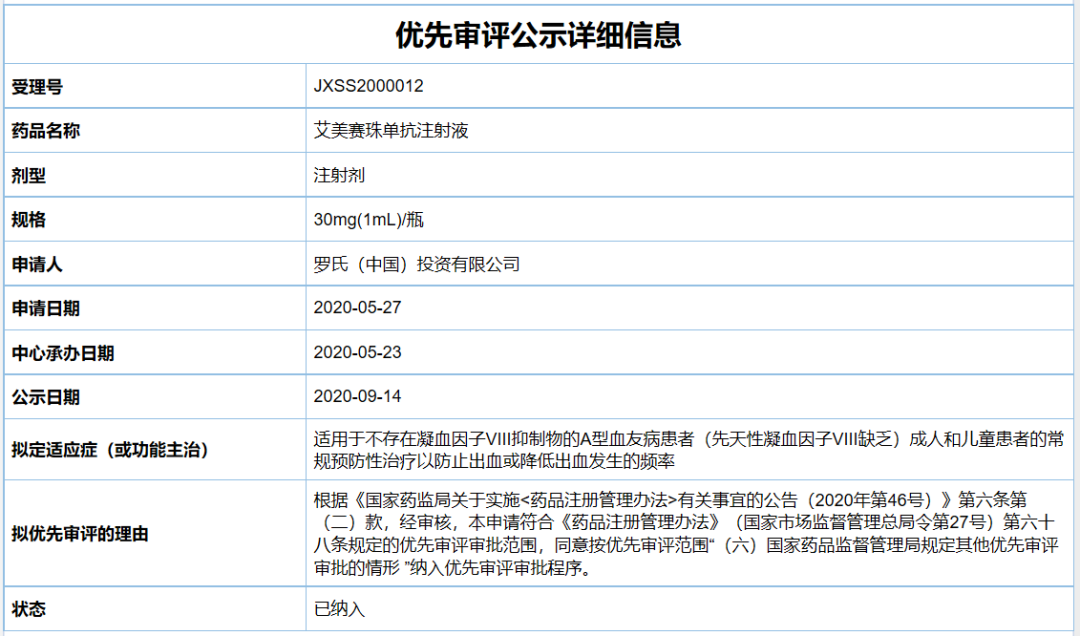
2020年5月,罗氏再次递交艾美赛珠单抗的新适应症上市申请,该申请还被CDE纳入优先审评,适用于
不存在
凝血因子VIII抑制物
的A型血友病患者。
根据罗氏早前发布的新闻稿,艾美赛珠单抗曾在两项针对体内不含因子VIII抑制物的A型血友病患者的3期试验中获得积极结果,研究显示它能显著降低患者需要治疗的出血情况,具有
良好的具有临床意义的出血控制结果
,且安全性良好。艾美赛珠单抗对于A型血友病患者群体而言是一款意义重大的新药,
可以减少出血情况,并使患者仅需每周、每两周或每四周进行一次注射即可。
希望罗氏艾美赛珠单抗新适应症早日在中国获批,从而为更多血友病患者带来获益。
注:本文旨在介绍医药健康研究进展,不是治疗方案推荐。如需获得治疗方案指导,请前往正规医院就诊。
[1]中国国家药监局注册进度查询. Retrieved May 4,2021, from http://sq.nmpa.gov.cn/datasearch_nmpa/schedule/search.jsp?tableId=43&tableName=TABLE43&columnName=COLUMN464,COLUMN475&title1=药品注册进度查询
[2] FDA approves Roche’s Hemlibra for haemophilia A without factor VIII inhibitors. Retrieved October 5, 2018, from https://www.roche.com/media/releases/med-cor-2018-10-04c.htm
版权说明:本文来自药明康德内容团队,欢迎个人转发至朋友圈,谢绝媒体或机构未经授权以任何形式转载至其他平台。转载授权请在「医药观澜」微信公众号留言联系我们。







 个人中心
个人中心
 我是园区
我是园区




