▎药明康德内容团队报道
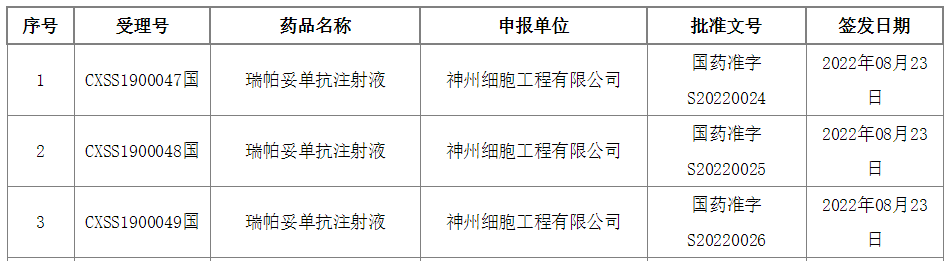
今日(8月30日),中国国家药监局(NMPA)官网最新公示,神州细胞递交的瑞帕妥单抗(ripertamab,SCT400)的上市申请已获得批准
。公开资料显示,瑞帕妥单抗是一款新型的抗CD20单抗,本次获批的适应症为联合CHOP(环磷酰胺+多柔比星+长春新碱+泼尼松)方案治疗弥漫性大B细胞淋巴瘤。

弥漫性大B细胞淋巴瘤(DLBCL)是最常见的非霍奇金淋巴瘤类型,它是一种进展迅速的侵袭性疾病。对于这类患者,抗CD20单抗是基石的治疗药物。
瑞帕妥单抗是神州细胞自主研发的一种人鼠嵌合IgG1型抗CD20单克隆抗体,
它的结构中包含了30%的鼠抗CD20单克隆抗体的可变区Fab,以及70%的人IgG1抗体稳定区Fc片段。根据神州细胞早前发布的新闻稿,与利妥昔单抗相比,瑞帕妥单抗的恒定区序列选用中国人血细胞提取的最常见天然IgG1同种异型G1m(1,17),在CH1区第219位的氨基酸存在差异——即瑞帕妥单抗是缬氨酸,而利妥昔单抗则为丙氨酸。
这样的一个氨基酸改变可以在保证药物有效性的前提下尽可能地降低药物的免疫原性
。
2019年12月,中国国家药监局药品审评中心(CDE)受理了瑞帕妥单抗的上市申请。根据神州细胞早前发布的新闻稿,该药本次申请上市的适应症为联合CHOP方案治疗DLBCL患者。
在一项3期临床试验中
,研究人员比较了瑞帕妥单抗-CHOP与利妥昔单抗-CHOP治疗初治DLBCL患者的疗效和安全性。该研究共纳入了364例初治DLBCL患者,研究的主要终点为客观缓解率(ORR)。根据2022年7月发表在Hematological Oncology杂志上的试验数据:
-
两组的ORR及完全缓解率(CRR)无显著差异。在独立影像学委员会(IRC)评估的ORR方面,瑞帕妥单抗-CHOP组为94.5%,利妥昔单抗-CHOP组为94.1%;在CRR方面,瑞帕妥单抗-CHOP组为70.5%,利妥昔单抗-CHOP组为75.4%。
-
两组间的1年无进展生存期(PFS)和3年总生存期(OS)无显著差异。
在1年PFS率方面,瑞帕妥单抗-CHOP组和利妥昔单抗-CHOP组分别为81.1%、83.2%;在3年OS率方面,瑞帕妥单抗-CHOP组为81.0%,利妥昔单抗-CHOP组为82.8%。
-
瑞帕妥单抗-CHOP和利妥昔单抗-CHOP两组总体安全性相似,无新的不良事件发生;在部分不良事件(如肺部炎症、间质性肺疾病、免疫原性等)方面,瑞帕妥单抗联合CHOP组更具优势。
综合以上数据,研究认为:与利妥昔单抗-CHOP方案相比,瑞帕妥单抗联合CHOP治疗DLBCL疗效具有非劣效性;而且,瑞帕妥单抗的免疫原性更低,在某些安全性事件上有一定优势。
神州细胞相信瑞帕妥单抗的获批将会为中国临床及患者提供一种新的治疗选择。
参考资料
[1]2022年08月30日药品批准证明文件待领取信息发布 . Retrieved Aug 30,2022, from https://www.nmpa.gov.cn/zwfw/sdxx/sdxxyp/yppjfb/20220830162157187.html
[2] 国产新型抗CD20单抗——瑞帕妥单抗III期临床研究结果正式发表.
Retrieved Aug 15,2022, from https://mp.weixin.qq.com/s/YVLlfDp2SZrgLKjPYFppFw
本文来自药明康德内容团队,欢迎个人转发至朋友圈,谢绝媒体或机构未经授权以任何形式转载至其他平台。转载授权请在「医药观澜」微信公众号留言联系我们。其他合作需求,请联系wuxi_media@wuxiapptec.com。
免责声明:药明康德内容团队专注介绍全球生物医药健康研究进展。本文仅作信息交流之目的,文中观点不代表药明康德立场,亦不代表药明康德支持或反对文中观点。本文也不是治疗方案推荐。如需获得治疗方案指导,请前往正规医院就诊。








 个人中心
个人中心
 我是园区
我是园区




