▎药明康德内容团队报道
今日,信达生物宣布授予Etana公司独家许可,将达攸同(贝伐珠单抗注射液)推向印度尼西亚市场。值得一提的是,这款产品
在美国和加拿大的商业化权益已于2020年1月授权给Coherus BioSciences,成为中国本土首个授权给美国公司的生物类似药。这两项授权合作的达成,可见国际上对信达生物生物类似药产品研发质量的认可。
回顾刚过去的2020年,信达生物取得了一系列里程碑进展。除了成功实现三款生物类似药的商业化外,信达生物还在创新药领域继续推进其PD-1抗体新药信迪利单抗(达伯舒)的多项临床,并在2020年获批超13项临床申请,涉及品种多达10款,它们大多数针对当下肿瘤免疫热门研发的靶点,如TIGIT、CD47、PD-1/L1、CTLA-4、LAG-3等。本文节选了信达生物在2020年取得的部分重要进展,仅供读者参阅。
公开资料显示,目前信达生物已建立起了一条包括23个新药品种的产品链,覆盖肿瘤、代谢疾病、自身免疫等多个疾病领域,其中4个产品获得NMPA批准上市,4个品种进入3期或关键性临床研究,另外还有15个产品已进入临床研究。
其中,核心产品信迪利单抗已在中国获批用于至少经过二线系统化疗的复发或难治性经典型霍奇金淋巴瘤的治疗。这是一款由信达生物和礼来公司(Eli Lilly and Company)共同开发的一款创新PD-1单克隆抗体,已被纳入中国国家医保目录。截至目前,信迪利单抗已在中国递交五项适应症上市申请。
公开资料显示,2020年4月,信迪利单抗联合含铂化疗用于一线非鳞状非小细胞肺癌(NSCLC)患者的新适应症上市申请(sNDA)获受理;2020年8月,其联合化疗治疗一线鳞状NSCLC患者的sNDA获受理;2021年1月,其用于治疗二线鳞状NSCLC患者和一线肝癌患者的sNDA获受理。目前,信迪利单抗共计有4项新适应症上市申请正在接受监管审查。
根据信达生物早前新闻稿,目前信迪利单抗有超过20多个临床研究正在进行,以评估信迪利单抗在各类实体肿瘤和血液肿瘤上的抗肿瘤作用,其中10多项是注册临床试验。该公司同时正在全球开展信迪利单抗的临床研究工作。
值得一提的是,信达生物与礼来公司已于2020年8月宣布扩大关于信迪利单抗的战略合作。根据协议,信达生物将授予礼来信迪利单抗在中国以外地区的独家许可,礼来将致力于将信迪利单抗推向北美、欧洲及其他地区。
截至目前,信达生物已为中国患者带来了3款生物类似药。其中,贝伐珠单抗注射液生物类似还相继获得Coherus BioSciences公司、Etana公司的授权引进,可见其产品研发质量已获得多方认可。
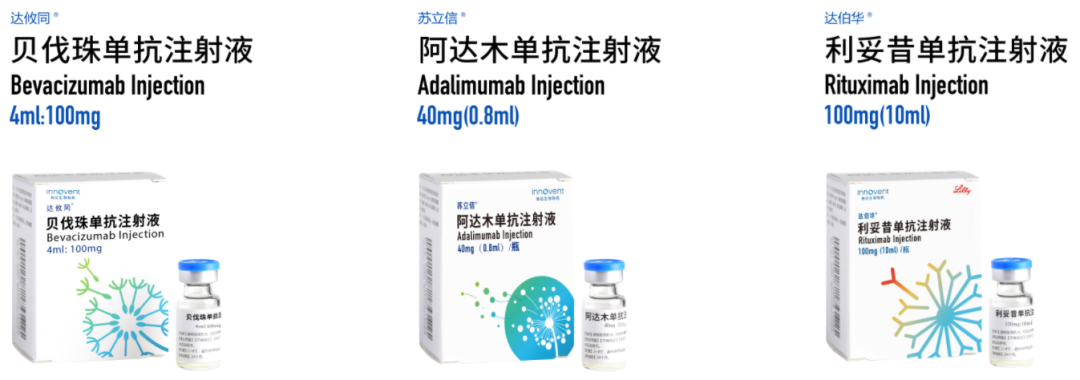
达攸同:
为贝伐珠单抗注射液生物类似药,又名重组抗VEGF人源化单克隆抗体注射液。它于2020年6月首次获得NMPA上市批准,用于治疗
晚期非小细胞肺癌和转移性结直肠
,并于2020年12月又获得NMPA批准用于治疗成人
复发性胶质母细胞瘤
。此外,达攸同的第四项适应症上市申请——联合信迪利单抗治疗一线肝癌患者,已于近期获得NMPA受理。
苏立信:
为阿达木单抗注射液的生物类似药,是信达生物研发的重组人抗TNF-α单克隆抗体。它于2020年9月首次获得NMPA批准上市,用于治疗
类风湿关节炎、强直性脊椎炎和银屑病
。2020年11月,苏立信又被NMPA批准用于治疗
多关节型幼年特发性关节炎
。2020年12月,苏立信再次获批两项新适应症,用于治疗
儿童斑块状银屑病和成年非感染性葡萄膜炎
。
达伯华:为
信达生物和礼来公司共同合作开发的一款利妥昔单抗生物类似药,属于重组人-鼠嵌合抗CD20单克隆抗体。它于2020年10月首次获得NMPA上市批准,用于治疗
部分淋巴瘤和白血病。之后,达攸同
于2020年12月再次获得NMPA批准用于治疗成人
复发性胶质母细胞瘤
。
据不完全统计,2020年信达生物获得超过13项临床试验批准,涉及产品有10款。这些产品中有多款新型双特异性抗体,也有PD-1抑制剂联合疗法,不少靶点为当下肿瘤免疫热门研发的靶点,如TIGIT、CD47、PD-1/L1、CTLA-4、LAG-3等(拓展阅读:。
1、TIGIT抗体IBI939
:一款重组全人源抗TIGIT单克隆抗体,可以直接结合TIGIT,阻断TIGIT与CD155结合产生的免疫抑制,解除T细胞及NK细胞的抑制和耗竭,进而促进T细胞及NK细胞介导的抗肿瘤效应。2020年1月,IBI939在中国获得临床试验默示许可,拟开发用于晚期肿瘤(血液肿瘤和实体瘤)。
2、新型抗CD47/PD-L1双抗IBI-322
:一种可同时靶向CD47和PD-L1的新型双特异性抗体。通过靶向CD47和PD-L1两个通路,IBI-322有望增强机体对肿瘤细胞的杀伤能力。2020年1月,IBI-322在中国获得临床试验默示许可,拟开发适应症为实体瘤和血液肿瘤。
3、GLP-1R/GCGR双重激动剂IBI362(OXM3)
:由礼来公司开发的一款新型降糖药,信达生物和礼来达成合作在中国共同开发和商业化这款候选药物。IBI362是一种源自肠道中前胰高血糖素基因转录后加工的一种天然肽类似物,可结合并激活GLP-1R和GCGR。2020年4月,IBI362在中国获得两项临床试验默示许可,拟开发适应症分别为2型糖尿病和减重。
4、IL-23抗体IBI112
:信达生物在研1类生物药,可选择性靶向IL-23的p19亚基而不靶向p40亚基的单克隆抗体,因此在不影响IL-12介导的病原防御和肿瘤免疫监视作用的前提下,可通过抑制IL-23/Th17通路来治疗银屑病等自身免疫疾病。2020年5月,IBI112在中国获批临床,拟开发适应症为克罗恩病、溃疡性结肠炎等自身免疫性疾病。
5、抗CTLA-4抗体IBI310
:一款由信达生物自主研发的重组全人源抗CTLA-4单克隆抗体。该产品通过靶向CTLA-4来上调人体效应性T细胞介导的抗肿瘤免疫反应和弱化调节性T细胞(Tregs细胞)介导的免疫抑制活性,进而抑制癌细胞的免疫逃逸,提高机体免疫应答。2020年10月,IBI310在CDE获得2项临床试验默示许可,拟开发适应症为晚期宫颈癌和晚期肝细胞癌。
6、抗GITR抗体IBI102
:一款靶向GITR的1类生物新药。研究表明,GITR和其他共刺激分子一样,对T细胞的激活起着关键作用,它的活性可以通过协同作用增强其他抗癌疗法的疗效,尤其是免疫检查点抑制剂。2020年10月,IBI102获得CDE临床试验默示许可,拟开发用于晚期恶性肿瘤。
7、新型LAG-3/PD-L1双抗IBI323
:信达生物开发的一款可以同时靶向LAG-3和PD-L1的双特异性抗体。根据公开资料,IBI323具有成为“first-in-class”新药的潜力。2020年10月,IBI323获得临床试验默示许可,拟开发用于治疗晚期恶性肿瘤。
8、CD47单抗IBI188(letaplimab)
:一种以CD47为靶点的重组全人源IgG4单克隆抗体,可增强巨噬细胞对肿瘤细胞的吞噬,并促进T细胞的交叉激活。2020年11月,IBI188获得临床试验默示许可,拟开发适应症为初诊中高危骨髓增生异常综合征。
9、PD-1/PD-L1双抗IBI318
:信达生物和礼来公司共同研发的一款重组全人源IgG1抗PD-1/PD-L1双特异性抗体。通过其双特异性能,桥接表达PD-1的T细胞和表达PD-L1的肿瘤细胞,使二者间形成免疫突触,从而有望提高抗肿瘤活性及疗效。早前,IBI318已在中国获批开展针对血液肿瘤和实体瘤的临床研究。2020年12月,IBI318获得一项新的临床试验默示许可,拟开发治疗复发或难治性结外NK/T细胞淋巴瘤(鼻型)。
10、PD-1抑制剂信迪利单抗
:2020年9月,信迪利单抗联合礼来公司开发的VEGFR2拮抗剂ramucirumab(雷莫芦单抗)获得临床试验默示许可,拟开发用于治疗一线不可切除的局部晚期或转移性胃及胃食管交界处腺癌。2020年10月,信迪利单抗再获临床默示许可,拟开发适应症为晚期肝细胞癌。
从上可以看到,除了已经进入商业化阶段的PD-1抗体信迪利单抗和三款生物类似药,信达生物在研产品管线丰富多样,研究的疾病领域涵盖多种实体瘤、血液癌症、自身免疫性疾病等。管线中尤其值得一提的是双特异性抗体,它已成为信达生物的重点研发领域之一。公开资料显示,该公司目前至少有8款双特异性抗体正在开发中,且大多为“first-in-class”产品,包括肿瘤细胞+免疫细胞产品,免疫细胞双靶点抑制和肿瘤细胞双靶点抑制。
双特异性抗体之外,信达生物也已开始开发细胞治疗产品。2020年6月,信达生物与罗氏(Roche)达成一项超20亿美元合作,合作范围主要为肿瘤细胞治疗和双特异性抗体。信达生物曾在新闻稿中表示,与罗氏达成战略合作标志着信达生物在细胞治疗发现平台建设方面迈出重要一步。
祝贺信达生物在2020年取得的一系列成就和进展,期待在未来,该公司可以将更多的好药、新药推向市场,造福广大病患。
版权说明:本文来自药明康德内容团队,欢迎个人转发至朋友圈,谢绝媒体或机构未经授权以任何形式转载至其他平台。转载授权请在「医药观澜」微信公众号留言联系我们。
欢迎扫码关注
“
医药观澜
”微信公众号
,了解更多中国医药创新动态。

注:本文旨在介绍医药健康研究进展,不是治疗方案推荐。如需获得治疗方案指导,请前往正规医院就诊。
参考资料:
[1] 信达生物授予Etana公司独家许可,将达攸同推向印尼市场. Retrieved Jan 18,2021, from https://mp.weixin.qq.com/s/RX1ide5V5g2vVH9UijjzVw
[2]信达生物官网










 个人中心
个人中心
 我是园区
我是园区




