

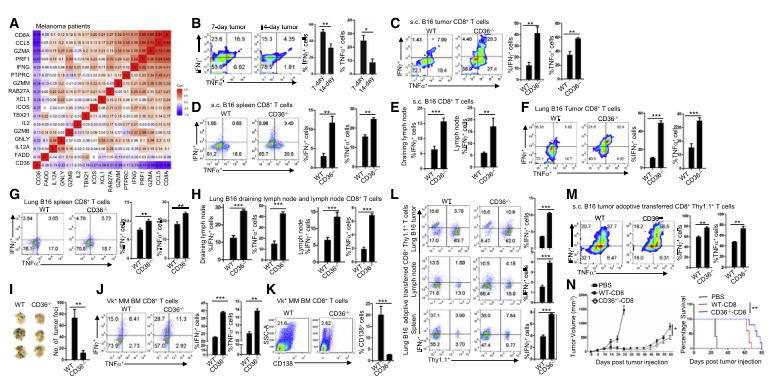
研究团队发现肿瘤浸润性CD8+T细胞上CD36的表达与肿瘤进展和生存不良有关。小鼠黑色素瘤和多发性骨髓瘤模型中,CD36的表达与肿瘤进展正相关, CD36在肿瘤浸润性CD8+T细胞上的表达随肿瘤进展而上调,CD36缺失可导致小鼠肿瘤较好的抗肿瘤反应。

人和小鼠CD8+T细胞中CD36的表达与细胞毒性细胞因子产生减少(IFN-γ, TNFa) 和抗肿瘤活性减弱有关。
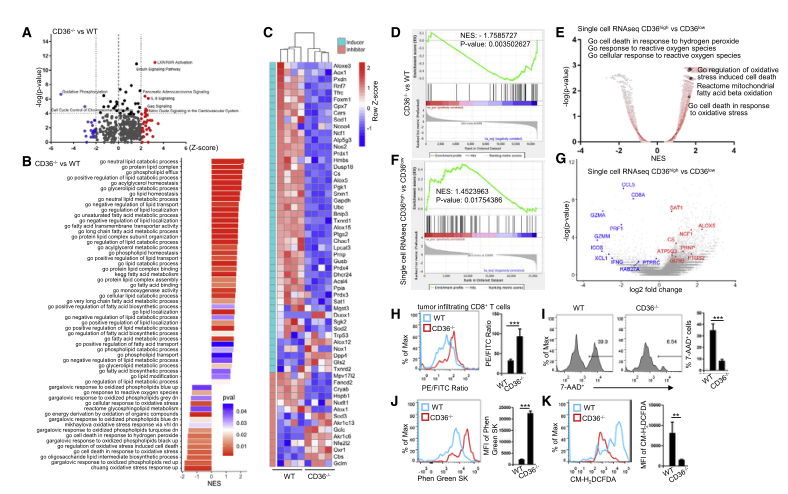
CD36介导的铁死亡可导致小鼠和人CD8+T细胞产生细胞毒性细胞因子减少。
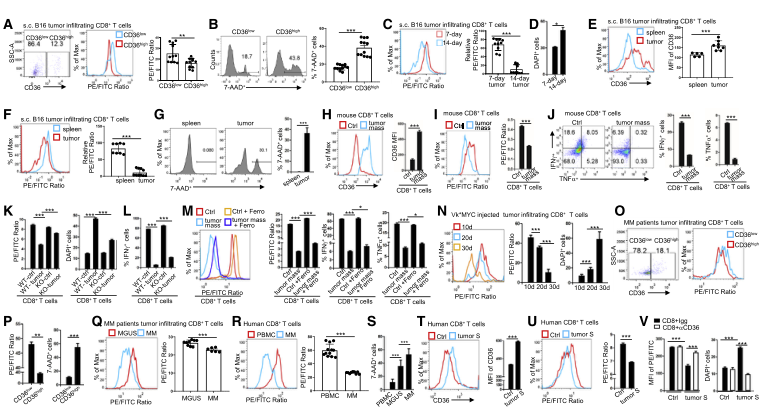
CD36通过摄取肿瘤环境中的脂肪酸,尤其是多不饱和脂肪-花生四烯酸,导致了CD8+T细胞内脂质过氧化物的堆积,铁离子含量升高,铁死亡过程增多,减少细胞毒性细胞因子的产生。

通过外源输入CD36缺失的CD8+T 细胞, 以及与PD1的联合免疫治疗,可以显著增强了CD8+T细胞的抗肿瘤作用。因此靶向铁死亡或CD36增强了CD8+T细胞和以ICB为基础的肿瘤免疫治疗。
尽管使用ICB来增强抗肿瘤反应的癌症免疫疗法在治疗多种恶性肿瘤方面取得了前所未有的成功,但临床应答率并不理想。主要问题之一是CD8+T细胞在遇到免疫抑制的肿瘤微环境(TME)时变得功能失调。
新陈代谢是决定T细胞分化、功能和命运的程度和性质的驱动力。保持T细胞代谢对确保T细胞功能十分重要。CD36是一种清道夫受体,在脂质代谢中发挥重要作用。作为一种膜糖蛋白,CD36已经在许多哺乳动物细胞类型中进行了研究,如脂肪细胞、巨噬细胞和肝细胞。然而,人们对它在T细胞中的作用知之甚少。之前的在Nature Immunology发表了一篇 “CD36-mediated metabolic adaptation supports regulatory T cell survival and function in tumors”的研究报告。报道了CD36在肿瘤内Treg细胞中选择性上调。CD36通过过氧化物酶体增殖物激活受体信号通路维持TME内Treg细胞的线粒体功能。Treg细胞中CD36的缺失抑制了肿瘤的生长。本研究发现CD36的表达与小鼠和人肿瘤浸润性CD8+T细胞脂质过氧化和铁死亡的激活相关。靶向CD36或 抑制CD8+T细胞的铁死亡增强了细胞的抗肿瘤功能。因此靶向CD36可能是提高T细胞免疫治疗抗肿瘤效果的有效策略。
参 考 文 献
1.CD36-mediated ferroptosis dampens intratumoral CD8+T cell effector function and impairs their antitumor ability.
2.CD36-mediated metabolic adaptation supports regulatory T cell survival and function in tumors.
作者 l 清风
版 权 声 明
欢迎个人转发分享。其他任何媒体、网站如需转载或引用本网版权所有内容须获得授权且在醒目位置处注明“转自:生物制药小编”。




 个人中心
个人中心
 我是园区
我是园区




