
前言
肿瘤免疫治疗近年来的突飞猛进,已经成为手术、放疗、化疗之后第四大肿瘤治疗技术。相较于以抗PD-1单抗为代表的免疫检查点抑制剂获批多个肿瘤适应症,并不断冲击目前的标准治疗方案。CAR-T细胞疗法则在血液肿瘤领域一骑绝尘,在实体瘤领域由于受到肿瘤浸润不足、T细胞功能障碍和衰竭的限制,进展缓慢。近年来,有研究团队尝试对实体瘤患者局部输送CAR-T细胞,研究结果是安全可行的,并能有效促进CAR-T细胞的渗透、扩散,并能激发持续的系统免疫功能。

CAR-T细胞疗法的局限性
CAR-T
(Chimericantigen receptor T-cell,嵌合抗原受体T细胞)疗法属于过继性T细胞转移(adoptive T-cell transfer,ACT)的一种,CAR(嵌合抗原受体)是一种基因工程技术制造的人工受体分子,它可以赋予免疫效应细胞(如T淋巴细胞)针对某个靶点抗原表位的特异性,从而增强T淋巴细胞识别抗原信号与活化的功能,继而回输淋巴细胞以实现抗肿瘤,抗病毒或抗炎作用。与免疫检查点抑制剂一样,也是依托于T淋巴细胞发挥主要作用。
相较于其他肿瘤治疗方式,CAR-T细胞不需要抗原递呈的机制而识别肿瘤抗原,因此能克服肿瘤细胞通过下调MHC以及降低抗原递呈而介导的免疫逃逸;而且同一种靶向分子的CAR-T细胞能应用于不同的病人;肿瘤非蛋白源性抗原的单链抗体,或肿瘤特异性受体的配体也可作为CAR的膜外识别片段;特别重要的是,由于引入了共刺激因子,不仅提高了T细胞的杀瘤效应,而且T细胞在患者体内的生存能力大为增强,并具有扩增的潜能。遂CAR-T细胞疗法成为当下阶段的主要研究热门领域。但CAR-T细胞疗法也有诸多局限性,导致其在临床应用缓慢。
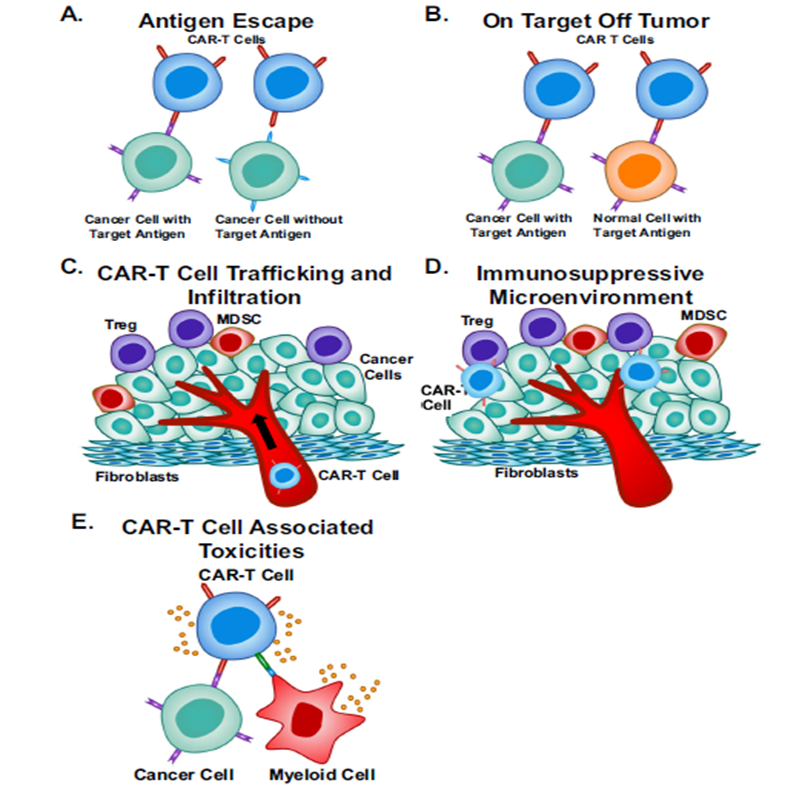
图1. CAR-T细胞疗法的局限性 [1]
CAR-T细胞疗法的局限性包括:A. 抗原逃逸;B. 脱靶效应;C. CAR-T细胞转运及浸润;D. 免疫抑制微环境;E. CAR-T细胞相关的毒性。
以CAR-T细胞相关的毒性和CAR-T细胞转运及浸润两方面,我们探讨通过局部输送CAR-T细胞的方式,是否能明显改善当下全身输送CAR-T细胞疗法应用的局限性。
尽管CAR-T细胞疗法难治/复发性血液肿瘤治疗效果显著,但临床毒副反应也是亟待解决的难题。特别是静脉注射后全身运行,会导致各种副反应的发生。
例如,神经系统并发症是CAR-T细胞治疗过程中常见的毒副反应之一,发生率为21%~66%。更为严重的毒副反应,如细胞因子释放综合征(CRS),虽然发生概率较低,但致死率较高。
图2. 与CAR-T细胞疗法相关的潜在毒性 [2]
☉ 神经毒性(neurotoxicity);
☉ 淋巴清除引起的相关毒性(血细胞减少、感染);
☉ 插入突变(insertional mutagenesisi);
☉ On-Target On-Tumor毒性(肿瘤溶解综合征);
☉ On-Target Off-Tumor(非肿瘤靶向毒性,B细胞再生障碍);
☉ 过敏反应(anaphylaxis);
☉ 交叉反应(Cross-reactivity);
☉ 细胞因子释放综合征(CRS);
实体瘤具有干扰T细胞转运进行免疫逃逸的机制。一方面,与血液肿瘤细胞呈分散状不同,实体瘤往往形成坚实的团状物,加上丰富的肿瘤相关成纤维细胞(CAF)和血管,形成了一层天然的物理屏障。另一方面,一些实体瘤会抑制某些趋化因子的分泌。趋化因子与其受体的相互作用会促进T细胞向肿瘤微环境的迁移。同时,CAR-T细胞表面也缺乏与实体瘤分泌的趋化因子相匹配的相关受体,造成CAR-T对肿瘤部位的归巢能力差。
图3. 实体瘤中的免疫抑制微环境 [3]
a. 效应细胞和靶细胞;b. 免疫抑制细胞和细胞因子;c. 物理屏障;d. 肿瘤内部微环境;e. 其他免疫抑制因素。
这就导致CAR-T细胞疗法只局限在血液肿瘤领域,在肿瘤患者人群基数更大的实体瘤领域,进展缓慢。

近年来,在实体瘤患者中,为改善CAR-T的浸润和转运难题,可采用局部注射给药的方式,比如脑部、乳腺、胸膜、肝脏等。另外,CAR-T细胞的局部注射也可能降低脱靶效应带来的风险。能够有效解决上述全身系统输送CAR-T细胞产生的毒副反应和CAR-T细胞转运及浸润能力不足的局限性。
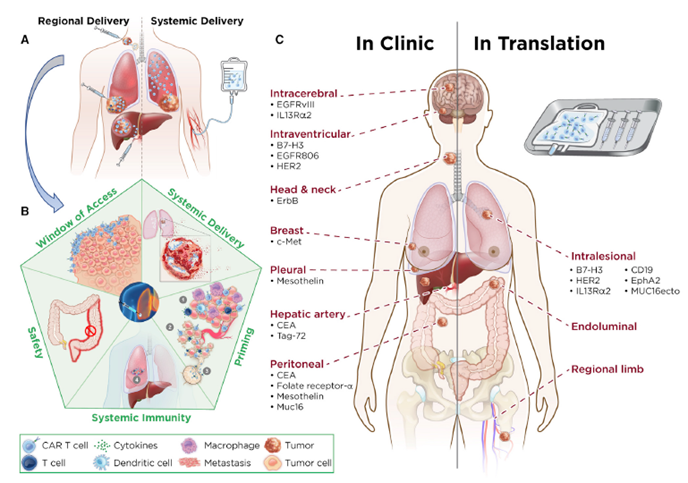
图4. CAR-T细胞的局部与系统输送 [4]
上图是2022年Cancer Cell上刊登的一篇综述,具体展示了相较于全身系统输送,局部输送CAR-T细胞疗法的优势:
◆ 区域输送可以增加CAR-T细胞的瘤内增殖,增加CAR-T细胞的穿透深度,增强CD4免疫辅助功能,更多地转运到转移部位,并引流到淋巴结内。全身给药导致CAR-T细胞在肺部隔离,浅层渗透到肿瘤中,并且没有CD4的免疫帮助功能。
◆ 区域输送有效促进CAR-T细胞产生系统免疫功能并更好地进入肿瘤发生部位,导致肿瘤溶解,并通过诱导肿瘤免疫微环境变化为适合系统免疫的微环境,包括通过肿瘤微环境中的效应器反应降低免疫抑制、肿瘤细胞死亡增加,导致强烈的免疫反应(通过释放新抗原排入局部淋巴结)、增加肿瘤血管对免疫细胞运转的敏感性,增加T细胞循环和进入转移部位。
◆ 任何实体瘤靶向免疫治疗的目标都应该不仅仅是对可见的原发性肿瘤产生有效的免疫反应,同时建立循环、持久的免疫力,以根除微转移疾病灶。来自临床前和临床研究的数据表明,CAR-T细胞疗法的区域输注能够有效抵消实体瘤的时空障碍和免疫抑制,从而产生消除疾病和防止复发所需的T细胞记忆。同时,有效避免系统毒性,即肝内给药时不会出现结肠炎。
图5. CAR-T细胞局部输送的临床试验
针对几种实体瘤的区域性CAR-T治疗正在进行转化临床试验。包括CNS肿瘤脑室内给药,腹膜疾病的腹膜腔给药、结直肠癌肝转移的肝动脉给药。这些区域的全身给药都会由于膜腔造成阻碍,相关早期临床试验还在进行中。
总结
区域给药将给药部位作为CAR-T细胞的集散地,克服了实体肿瘤的治疗障碍,可以有效控制原发肿瘤,并建立循环免疫记忆性,有效阻止肿瘤的复发。但对于拥有多个转移灶的患者的治疗效果、区实体瘤区域给药受到的输送量(通常30-120ml)和输送通道安全性的限制,局部细胞因子风暴的产生也会对患者造成一定风险,也是目前亟待解决的难题。
参考文献:
[1]Blood CancerJournal, 11(4), 1-11.
[2]Annu Rev Med. 2021 Jan 27;72:365-382.
[3] Molecular cancer, 17(1), 1-12.
[4] Cancer Cell. 2022 Apr 22;S1535-6108(22)00168-4.
“药渡”公众号所转载文章来源于其他公众号平台,主要目的在于分享行业相关知识,传递当前最新资讯。图片、文章版权均属于原作者所有,如有侵权,请及时告知,我们会在24小时内删除相关信息。











 个人中心
个人中心
 我是园区
我是园区




