



Figure 2. (A) 内质网外膜钙瞬变触发FIP200复合物发生液-液相分离。(B) 内质网表面的FIP200凝聚体发生融合。
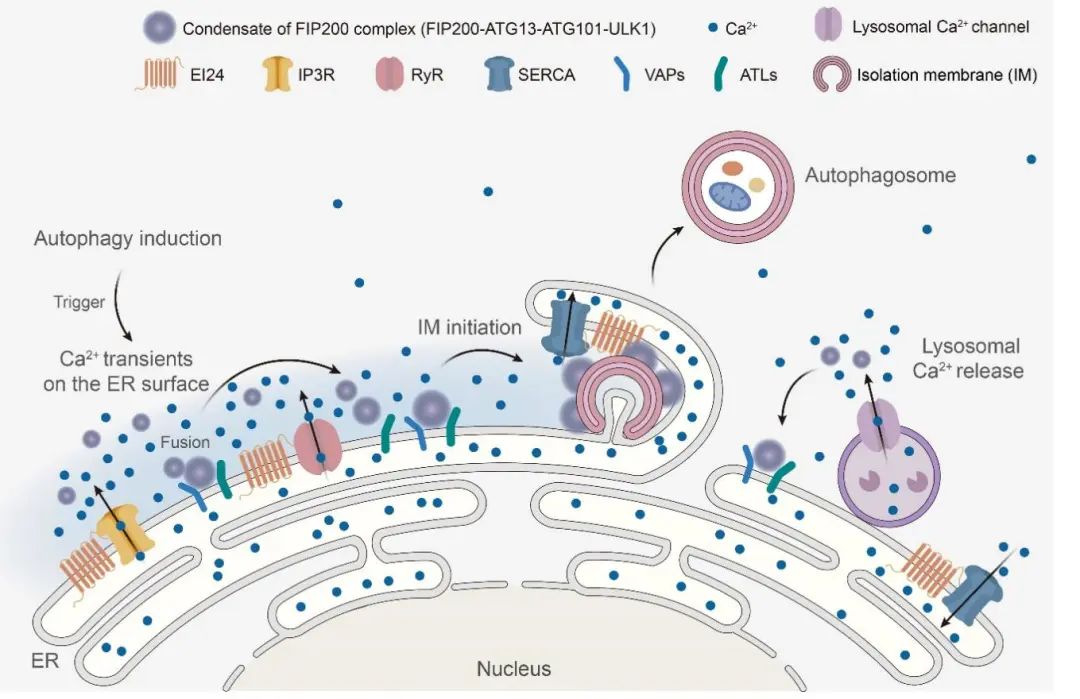
Figure 3. 内质网外膜钙瞬变触发FIP200复合物发生液-液相分离,并定位于内质网形成自噬起始位点的模式图。
在张宏实验室的这项极其出色的工作中,他们通过发展新型灵敏的Ca2+传感检测器,发现发生在内质网膜外表面Ca2+的瞬变信号是启动自噬体形成的关键,它能促进FIP200/ATG13/ULK1复合物的组装,而且这种Ca2+瞬变的频率、振幅和持续时间至关重要。他们还鉴定出内质网贯膜蛋白EI24(EPG-4)能与内质网膜上的Ca2+通道蛋白相互作用,通过造成重要Ca2+通道蛋白IP3R在内质网膜上的群集,决定内质网膜表面的Ca2+瞬变。同时,他们还发现溶酶体中Ca2+的释放也参与FIP200复合物在内质网表明的聚集,证明细胞中不同细胞器产生的Ca2+信号在膜接触位点的交互联系。张宏实验室既往在细胞内液相分离的形成和功能研究中有重要发现,阐明了自噬关键转录因子TFEB在核内的液相分离对自噬的调控作用。而且,他们还和胡俊杰实验室合作,鉴定出内质网蛋白VAP和ATL2/3在ULK1复合物在内质网上组装部位决定中的作用。该项研究中,他们进一步证明,内质网膜表面Ca2+瞬变是通过触发形成依赖ATG13的FIP200的液相分离促进ULK1复合物的组装,而VAP和ATL2/3蛋白在其中发挥重要作用。最后,它们发现ATG9囊泡能调节FIP200的这种相分离及其在内质网膜上的空间组织,阐明了ATG9与ULK1相互作用在自噬体形成中的意义和功能。
总之,这是一项极具工作量和涉及多方面分子细胞实验技术的工作,丰富内容、信息量大。不仅回答了Ca2+信号如何调控自噬启动这一领域内长期存在的问题,还明确了ULK1复合物在内质网膜上组装和激活的诸多细节,实为张宏组在继自噬领域众多成果后的又一重要发现,必将得到广泛关注。
制版人:十一
参考文献
1. Lamb, C.A., Yoshimori, T., and Tooze, S.A. (2013). The autophagosome: origins unknown, biogenesis complex. Nat. Rev. Mol. Cell Biol. 14, 759–774.
2. Zhao, Y.G., Codogno, P., and Zhang, H. (2021). Machinery, regulation and patho-physiological implications of autophagosome maturation. Nat. Rev. Mol. Cell Biol. 22, 733–750.
3. Nakatogawa, H. (2020). Mechanisms governing autophagosome biogenesis. Nat. Rev. Mol. Cell Biol. 21, 439-58.
4. Fujioka, Y., Alam, J.M., Noshiro, D., Mouri, K., Ando, T., Okada, Y., May, A.I., Knorr, R.L., Suzuki, K., Ohsumi, Y., et al. (2020). Phase separation organizes the site of autophagosome formation. Nature 578, 301-305.
5. Zhao, Y.G., and Zhang, H. (2018). Formation and maturation of autophagosomes in higher eukaryotes: a social network. Curr. Opin. Cell Biol. 53, 29–36.
6. Karanasios, E., Walker, S.A., Okkenhaug, H., Manifava, M., Hummel, E., Zimmermann, H., Ahmed, Q., Domart, M.C., Collinson, L., and Ktistakis, N.T. (2016). Autophagy initiation by ULK complex assembly on ER tubulovesicular regions marked by ATG9 vesicles. Nat. Commun. 7, 12420.
7. Tian, Y., Li, Z., Hu, W., Ren, H., Tian, E., Zhao, Y., Lu, Q., Huang, X., Yang, P., Li, X., et al. (2010). C. elegans screen identifies autophagy genes specific to multicellular organisms. Cell 141, 1042–1055.
8. Zhao, Y.G., Chen, Y., Miao, G., Zhao, H., Qu, W., Li, D., Wang, Z., Liu, N., Li, L., Chen, S., et al. (2017). The ER-localized transmembrane protein EPG-3/VMP1 regulates SERCA activity to control ER-isolation membrane contacts for autophagosome formation. Mol. Cell 67, 974-989.




转载须知
【原创文章】BioArt原创文章,欢迎个人转发分享,未经允许禁止转载,所刊登的所有作品的著作权均为BioArt所拥有。BioArt保留所有法定权利,违者必究。




 个人中心
个人中心
 我是园区
我是园区





