Nature | 陈玲玲团队揭示核仁的超微精细结构——非流动性蛋白URB1在核仁液-液相分离环境中的关键组织作用
收藏
关键词:
液相NatNature揭示
资讯来源:BioArt + 订阅账号
发布时间:
2023-03-09

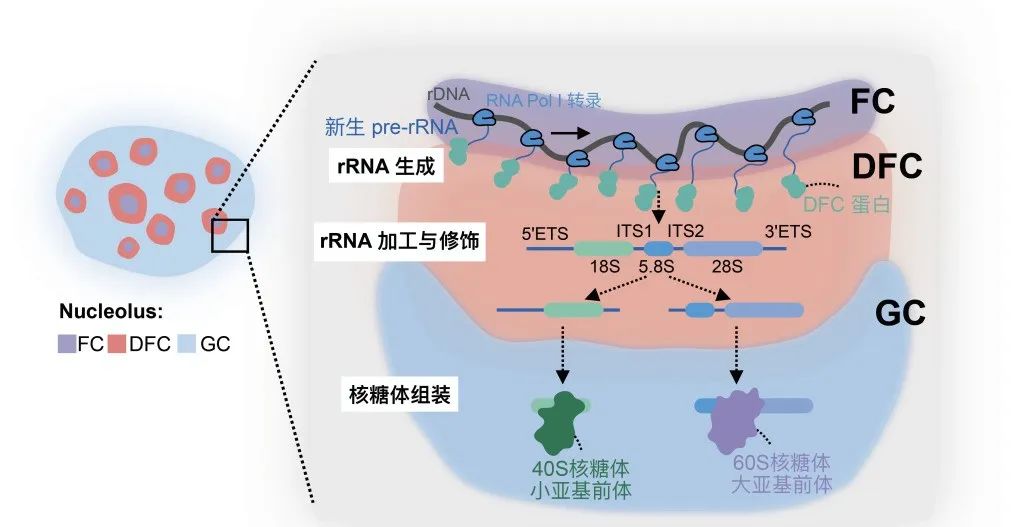
核仁
是细胞核内一个复杂且高度动态变化的无膜亚结构,是细胞核内核糖体RNA
(ribosomal RNA,
rRNA
)
的加工厂。它在调节rRNA的转录、加工以及核糖体亚基组装中发挥着重要作用
【1,2】
。核仁在形态上由内而外可以分为三层结构:多个纤维中心
(Fibrillar Center,
FC
)
和致密纤维组分
(Dense Fibrillar Component,
DFC
)
形成球状结构镶嵌在颗粒区
(Granular Component,
GC
)
内。RNA聚合酶I转录复合物聚集在FC区域边缘对核糖体DNA
(rDNA)
进行转录;rRNA前体
(pre-rRNA)
加工蛋白质在DFC区域参与调控rRNA前体的定向转运和核仁DFC环簇状结构的组装
【3】
。这些在FC/DFC单元产生的rRNA占细胞内总RNA的约85%,因此在FC/DFC中rRNA成熟的过程是一个受到精密调控的过程。加工修饰完成的pre-rRNA进入GC区域参与核糖体亚基的组装
(图1)
。核仁的重要功能毋庸置疑,但大多数核仁蛋白质的精确定位及其如何参与pre-rRNA高效有序加工等基础生物学问题尚不清楚。
图 1 核糖体RNA和核糖体亚基在核仁内高效有序加工和组装
2023年3月2日,陈玲玲研究组在Nature杂志在线发表题为
Nucleolar URB1 ensures 3' ETS rRNA removal to prevent exosome surveillance
的研究论文。该工作
利用高分辨率活细胞显微成像技术,通过筛选200个核仁候选蛋白质发现12个在纤维中心/致密纤维组分
(
FC/ DFC
)
外围富集的蛋白质,并命名该区域为致密纤维组分外侧区域
(periphery of DFC,
PDFC
)
。深入解析发现,位于PDFC的
URB1
(unhealthy ribosome protein 1)
是一种具有非流动特征的核仁蛋白质,对维持PDFC的完整性、锚定pre-rRNA 3’端及保证其正确折叠和加工起到至关重要的作用。该工作
揭示了核仁的超微精细结构,为解析核仁的功能和结构提供全新见解,为深入研究核仁蛋白质在pre-rRNA加工中的功能协调以及对核糖体生成和胚胎发育影响提供全新思路。
图 2 高分辨率活细胞筛选发现核仁全新特征区域-PDFC
研究人员利用CRISPR/Cas9技术构建了DFC/GC双色荧光蛋白质标记的参考细胞系,在此细胞系内对200个核仁候选蛋白质进行了高分辨率的活细胞成像,并筛选到140个定位在细胞核仁不同亚结构区域的蛋白质。对这140个核仁蛋白质的深入研究发现,12个蛋白质定位于DFC外部,形成厚度约为200 nm的球壳状新结构,被命名为PDFC,其中包括URB1。研究发现URB1具有分子量大,蛋白质流动性慢的特征,对于维持PDFC的结构和功能至关重要。进一步地,研究人员利用光学超分辨显微成像系统性地完善了核仁的精细亚结构分析,为更好认识核仁组织结构和工作机制提供了重要基础
(图2)
。
核仁内pre-rRNA的转录、加工和组装是一个复杂过程
【4,5】
,其中该过程如何与核仁亚结构组成和功能相耦联尚未解析,新发现的PDFC核仁亚结构的功能也有待探索。研究人员发现PDFC关键蛋白质URB1调控pre-rRNA 3’末端ETS 区域
(External transcribed spacer, ETS)
折叠和加工。其在PDFC的定位参与了3’ETS的锚定、折叠与去除。URB1缺失导致3’ETS折叠异常、U8 snoRNA与pre-rRNA的结合受阻、从而导致3’ETS的加工异常。
这些异常的pre-rRNA中间产物在核仁中大量累积,进而激活RNA稳态监控系统
(RNA Exosome)
在核仁发挥活性,引发异常pre-rRNA的降解,导致成熟的28S rRNA减少,无法维持细胞内核糖体的稳态和蛋白质合成,因此造成斑马鱼和小鼠的早期发育缺陷,甚至死亡
(图3)
。
图3 PDFC蛋白质URB1调控pre-rRNA生成及胚胎发育。a.12个PDFC蛋白质的超高分辨率细胞成像 b.Urb1敲除导致斑马鱼颅骨发育异常 c.URB1缺失导致3’ETS异常保留的pre-rRNA在核仁内累积 d.URB1缺失激活RNA稳态监控系统(RN在核仁发挥活性)
此项研究工作利用超高分辨率生物成像、单分子RNA成像、RNA二级结构解析以及动物模型等多种研究手段,
全面揭示了核仁精细结构与pre-rRNA的加工相互协同,共同维持核仁内微环境稳定,为认识核仁功能提供了全新的见解。
此外,该研究证明了URB1这类非流动性蛋白质在核仁液-液相分离环境中的关键组织作用,对深入理解三维pre-rRNA加工机制、核仁组装形成和功能提供了新的思路
(图4)
。
图4 核仁蛋白质协同核仁精细结构与pre-rRNA加工的新机制
中国科学院分子细胞科学卓越创新中心陈玲玲研究组博士研究生单琳和许光
(现为麻省理工学院博士后)
为该论文的共同第一作者,陈玲玲研究员为该论文通讯作者。特别感谢复旦大学生物医学研究院/复旦大学附属儿童医院杨力研究员、中国科学院分子细胞科学卓越创新中心李劲松院士、清华大学俞立教授和北京协和医院医学科学研究中心黄超兰教授的大力帮助。
https://doi.org/10.1038/s41586-023-05767-5
陈玲玲研究组长期从事RNA加工代谢与功能机制研究。近年来不断创新研究手段揭示长非编码RNA和环形RNA作用机制、细胞核亚结构组装和功能等基础科学问题,发现了环形RNA生成和功能新机制及应用潜能(Mol Cell 2017, Cell 2019, Nat Methods 2021, Mol Cell 2022)、长非编码RNA加工和功能机制密切耦联(Nat Cell Biol 2018; Mol Cell 2019a, Cell 2020)、以及核仁结构新组成和功能新模型(Cell 2017; Mol Cell 2019b; Science 2021, Nature 2023)等。受邀在Science(2017)、Mol Cell (2018)、Nat Rev Mol Cell Biol(2016/2020/2021)、Nat Cell Biol(2019/2023)、Nat Methods(2022)、Cell(2022)等期刊发表综述和评论总结领域前沿进展。
陈玲玲近期入选新基石研究员,研究团队坐落在具有悠久历史的中科院分子细胞科学卓越创新中心(http://cemcs.cas.cn/rczp/bshzp/202207/t20220727_6494551.html)。现诚聘2~3位优秀博士后加入研究团队,从事1)化学RNA生物学方向探究RNA在体功能和诊疗相关应用;2)分子细胞生物学方向探究RNA在细胞核亚结构中的功能调控,共同推进超高分辨、实时动态、在体原位非编码RNA研究的新范式。
有意应聘者请准备以下材料进行投递(应聘理由请注明“应聘-博士后”),请提供1) 应聘函(包括对应聘职位的理解、及未来博士后工作的设想等);2) 个人简历(包括证件照、科研经历、发表论文等);3) 三位推荐人和三封推荐信;4) 其它能证明应聘者科研能力和其它素质的材料。我们将根据应聘材料择优面试。应聘材料恕不退还,将予以严格保密。
https://jinshuju.net/f/ZqXwZt
或扫描二维码
投递简历
制版人:十一
1. Lafontaine, D.L.J., et al., The nucleolus as a multiphase liquid condensate. Nature Reviews Molecular Cell Biology, 2021. 22(3): p. 165-182.
2. Boisvert, F.M., et al., The multifunctional nucleolus. Nat Rev Mol Cell Biol, 2007. 8(7): p. 574-85.
3. Yao, R.W., et al., Nascent Pre-rRNA Sorting via Phase Separation Drives the Assembly of Dense Fibrillar Components in the Human Nucleolus. Mol Cell, 2019. 76(5): p. 767-783 e11.
4. Xing, Y.H., et al., SLERT Regulates DDX21 Rings Associated with Pol I Transcription. Cell, 2017. 169(4): p. 664-678 e16.
5. Wu, M., et al., lncRNA SLERT controls phase separation of FC/DFCs to facilitate Pol I transcription. Science, 2021. 373(6554): p. 547-555.

【非原创文章】本文著作权归文章作者所有,欢迎个人转发分享,未经作者的允许禁止转载,作者拥有所有法定权利,违者必究。












 药选址
药选址










