


前列腺癌(PCa)是第二常被诊断为实体瘤,也是全球男性癌症相关死亡第五大原因,2022年估计有268,490例新病例。此外,在过去十年中,转移性PCa诊断的发病率一直在上升,从2007年的3.9%上升到2018年的8.2%[1]。

尽管诊断和治疗有所改善,但很大一部分早期PCa患者进展为转移性去势抵抗性前列腺癌(mCRPC)。此外,在新型抗雄激素疗法和可用的标准化疗进展之后,难治性转移性前列腺癌的治疗顺序和预后仍然是一个主要挑战。
因此,在过去二十年中,难治性mCRPC的治疗范围已经扩大,新的治疗批准包括放射性同位素治疗、基因定向治疗和免疫检查点抑制剂[2]。然而,只有少数患者有资格使用这些药物,反应可能有限。因此,开发转移性CRPC的新药物和治疗策略仍然是一个重要目标。
对于这种未满足的需求,在了解肿瘤病理学方面的进展之后发现在癌细胞上过度表达的新型抗原,可用作更特异性的治疗靶点。在这种情况下,抗体-药物偶联物(ADC)作为一种新的药物概念出现,它使用靶向特定肿瘤抗原的单克隆抗体(mAb),并将细胞毒性有效载荷剂附着在mAb上。
此外,ADC在治疗其他肿瘤类型方面显示出巨大的临床活性,特别是在人表皮生长因子受体2(HER2)阳性乳腺癌,全球共两款HER2 ADC药物获批上市,分别是罗氏的Kadcyla(T-DM1)和阿斯利康/第一三共的Enhertu(DS-8201),前者于2013年获FDA批准上市,获批的适应症包括HER2阳性转移性乳腺癌和HER2阳性早期乳腺癌;后者于2019年12月获FDA批准上市,适应症为HER2阳性乳腺癌,2021年1月将适应症拓展至HER2阳性胃或胃食管交界腺癌。
目前还没有ADC被批准用于前列腺癌(PCa)的,但有一些靶向不同抗原的ADC在临床研究中,如PSMA,TROP-2,STEAP1,TF 和 DLL-3等(图2)[3]。

图2. 前列腺癌细胞中的抗体-药物偶联物和靶标

前列腺特异性膜抗原(PSMA)是一种II型跨膜糖蛋白,其功能为锌金属酶,存在于前列腺上皮上。在正常前列腺组织中,PSMA表达和定位集中在前列腺导管周围的细胞质和上皮的顶端。然而,在前列腺癌发生期间,PSMA被转移到导管的管腔表面。
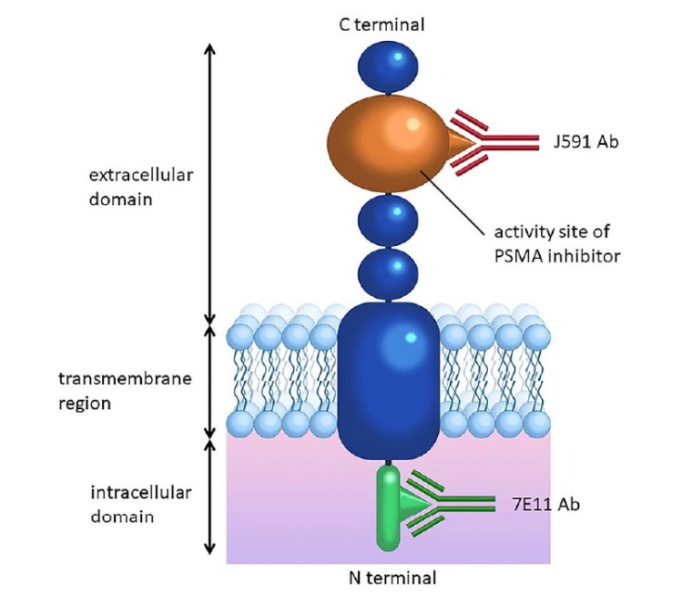
图3. PSMA的结构
PSMA在绝大多数前列腺癌细胞中高表达(正常值的100-1000倍),包括晚期疾病患者、去势抵抗性疾病患者和低分化疾病患者。此外,PSMA对前列腺癌细胞的内化率很高。
由于其在前列腺癌中的普遍存在以及上述特征,PSMA已成为前列腺癌患者影像学模式和治疗方法研究的有吸引力的目标,在患者的初始分期,疾病异质性表征,复发检测,反应监测和治疗诊断干预方面具有实用性。基于PSMA的方法也可能允许一定程度的预后,因为PSMA与其截短亚型(PSM')的比例与肿瘤侵袭性成正比。
这是一个成熟的靶向前列腺癌的诊断和治疗领域,目前开发的PSMA的ADC有MLN2704,PSMA-MMAE,MEDI3726,BIND014和ARX517等。
MLN2704是一款将人源化单克隆抗体MLN591 抗体与美登木素生物碱-1(DM1)偶联的ADC。临床1/2 期多次递增剂量试验表明MLN2704神经毒性是剂量限制性的。
总体而言,44例患者(71%)表现出周围神经病变:6例(10%)为3/4级。尽管将给药间隔增加到3周和6周,神经毒性发生率仍然很高。MLN2704药代动力学呈剂量线性。观察到DM1与偶联抗体的快速解偶联。总共有5名患者(8%)前列腺特异性抗原(PSA)下降了50%;5例(8%)的PSA稳定持续90天。35 名患者中只有2名在3周和6周的时间表上PSA下降了超过50%(图4)。
MLN2704在转移性去势抵抗性前列腺癌中的活性有限。二硫键接头的不稳定性和快速去缀合导致神经毒性和狭窄的治疗窗口。基于此,已经终止MLN2704的研发[4]。
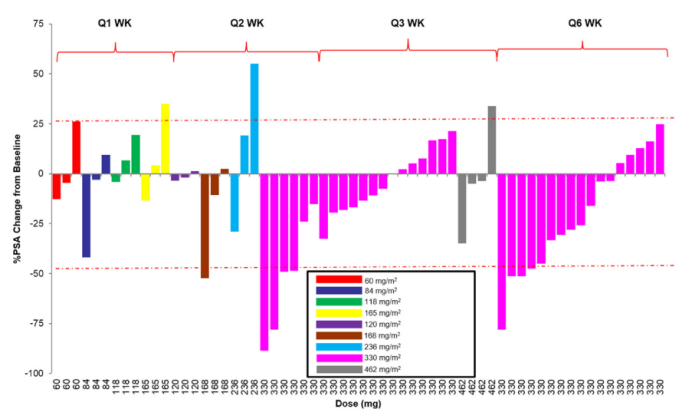
图4. 所有患者 PSA 的最大下降幅度
PSMA-MMAE是一种全人源免疫球蛋白G1抗PSMA单克隆抗体,与单甲基奥利他汀E偶联,与PSMA阳性细胞结合并诱导细胞毒性。在一项1期研究中,PSMA-MMAE耐受性良好,并减少血清前列腺特异性抗原(PSA)和循环肿瘤细胞(CTCs)。
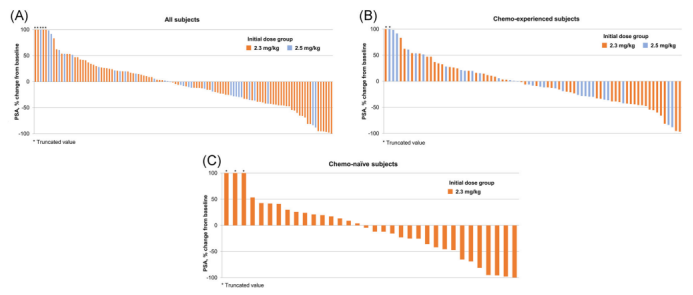
图5. PSA响应的瀑布图
MEDI3726是一种抗体-药物偶联物,靶向前列腺特异性膜抗原和携带吡咯烷苯二氮卓弹头tesirine药物。
一项I期研究评估了MEDI3726单药治疗在接收阿比特龙和/或恩杂鲁胺和紫杉烷类化疗后转移性去势抵抗性前列腺癌患者中疗效。尽管在通常结局较差的患者群体中,临床活性有限,特别是在测试的较高剂量下,但新出现的治疗相关毒性限制了治疗的持续时间,并阻止了进一步计划的剂量增加。
在一项未接受过化疗的mCRPC Ⅱ期临床试验中发现,BIND-014(一种新型 PSMA-ADC)耐受性良好,患者可能从治疗中受益。优化剂量给药,结合更合适的细胞毒性药物,以及选择合适的患者,是未来提高 PSMA-ADC疗效的方向。
AMBRX专有的抗PSMA ADC ARX517在晚期前列腺癌患者中显示出令人鼓舞的单药安全性和有效性数据。
1. 正在进行的1期剂量递增试验(APEX-01)的首次临床数据显示,接受 ARX517 治疗的3名转移性前列腺癌患者中,有3名患者的PSA比基线降低>50%(队列6)。2. 队列6中3名患者中有2名的PSA水平降低了90%以上;3. 未观察到与药物相关的严重不良事件(SAE)或剂量限制毒性(DLT)。
这些数据为单药ARX517作为晚期前列腺癌ADC治疗的概念验证提供了早期证据。

Trop-2是一种在许多上皮癌中过度表达的跨膜钙信号转导器,被认为与疾病进展和转移(包括前列腺癌)的发展相关。TROP-2包含一个274个氨基酸的细胞外表皮生长因子样重复部分,其中包含3个结构域、一个富含半胱氨酸的结构域、一个甲状腺球蛋白1型结构域和一个半胱氨酸贫结构域。该分子穿过膜并以细胞质尾终止,该尾部在位置303处具有可以磷酸化的丝氨酸。该分子在细胞外结构域具有4个N-糖基化位点[6]。
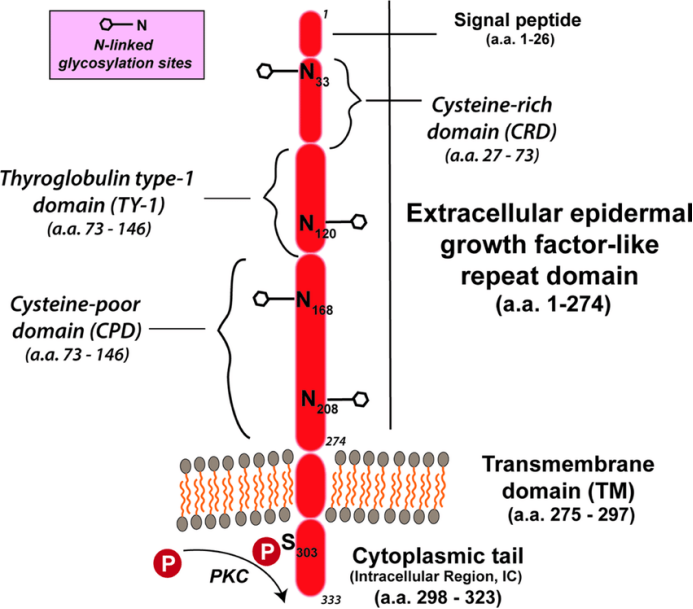
Sacituzumab govitecan(Trodelvy™)是一种以SN-38为有效载荷的Trop-2定向抗体药物偶联物,已被FDA批准用于治疗晚期三阴性乳腺癌。现在临床上也在研究它的其它适应症。
三项关于TROP-2 ADC的I/II期试验正在进行的招募(表1)。
2.第二项试验正在研究Datopotamab-Deruxtecan(Dato-DXd),这是一种针对TROP-2的人源化单克隆抗体,与脱氧核糖核酸(DNA)拓扑异构酶I抑制剂相连,Dato-DXd正在单独研究或与其他药物联合用于晚期或转移性实体肿瘤;
3.第三项试验正在研究IMMU-132,这是一种靶向TROP-2的单克隆抗体,并与伊立替康的活性代谢物(SN38),在 mCRPC 环境中,在至少既往一线恩杂鲁胺或阿比特龙。

STEAP1主要在前列腺细胞中表达,在正常组织中表达低或不存在。在这种情况下,它是成像和治疗干预的潜在细胞表面靶标。
89Zr-DFO-MSTP2109A是由微管抑制剂monomethyl auristatin E (MMAE)与STEAP1抗体偶联而得。
89Zr-DFO-MSTP2109A耐受性良好,在骨和软组织中的mCRPC位点显示定位。鉴于高SUV在肿瘤和大量病变的定位,该试剂值得进一步探索,作为患者的伴随诊断接受STEAP1定向治疗(图7)[7]。
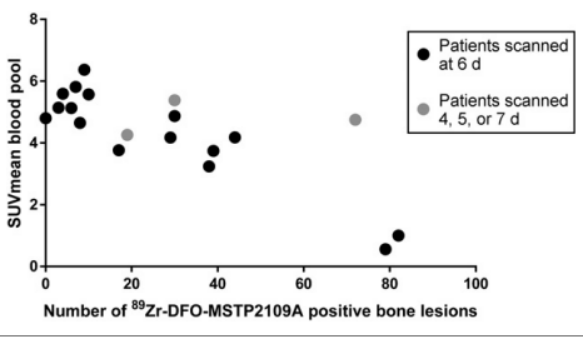
图7. 在89Zr-DFO-MSTP2109A 上发现的病变数量与血池中放射性清除呈负相关

组织因子(TF)是一种跨膜糖蛋白,作为外源性凝血途径的主要引发剂,也负责与不良临床结果(肿瘤生长、血管生成和转移)相关的细胞信号传导特性。Tisotumab vedotin是针对组织因子的首个人体抗体药物偶联物,在临床上开展I/II期试验。
共有27名复发,晚期或转移性实体瘤患者在剂量递增阶段入组,其中4名患有前列腺癌。不需要组织因子的表达。之后147例患者在剂量扩展阶段接受了推荐的2期剂量治疗,其中8例是前列腺癌患者。主要终点是所有接受至少一剂tisotumab vedotin的患者的安全性和耐受性。抗肿瘤活性是次要终点。
27%的患者报告了与研究药物相关的严重AE(n=39),更常相关伴有呕吐、腹痛和贫血。研究期间报告了9例死亡:3例在剂量中递增阶段和六次在剂量扩展阶段。
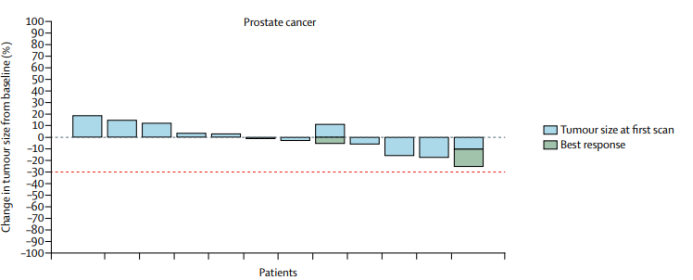
在剂量扩展阶段,数据截止时的中位随访时间为2.8个月,ORR占整个治疗人群的12.6%。既无影像学检查,在前列腺癌患者也无前列腺特异性抗原报告[8]。

DLL-3是Notch信号通路中的配体,在神经内分泌起源的肿瘤中高度表达,例如神经内分泌癌(NEC)或神经内分泌肿瘤(NET),与细胞周期发育和死亡信号传导有关。Rovalpituzumab tesirine(Rova-T)是一种靶向DLL3抗体-药物偶联物。
NEC和其他表达DLL3的晚期肿瘤患者参加了Rova-T 的I/II期研究(NCT02709889)。主要终点是安全。
200名患者入组:101例NEC/NET(大细胞NEC、胃肠胰NEC、神经内分泌前列腺癌和其他NEC/NET)和99例伴有其他实体瘤(黑色素瘤、甲状腺髓样癌 [MTC]、胶质母细胞瘤等)。
建议的第二阶段剂量(RP2D)为每6周0.3mg / kg(q6w),持续两个周期。在RP2D中,3/4级不良事件包括贫血(17%),血小板减少症(15%)和天冬氨酸氨基转移酶升高(8%)。在15/145(10%)患者中确认了反应治疗剂量为0.3mg/kg,包括9/69例(13%)NEC/NET患者。0.3 mg/kg q6w的Rova-T具有可控的毒性,在 NEC/NET、黑色素瘤、MTC 和胶质母细胞瘤患者中观察到抗肿瘤活性[9]。
其它涉及到前列腺癌的靶点包括B7-H3和Her2等,靶向它们的ADC的临床试验如下表2。
转移性结直肠癌的治疗具有挑战性,对大多数现有治疗方法的反应仍然有限。ADC的使用可能会改变这一现实,尽管目前现有数据仅倾向于使用抗PSMA ADC,认为其可能有益。此外,ADC的试验的解释和适用性受到样本量小的限制,并且纳入人群的研究异质性以及不同试验中使用的主要终点。然而,大多数有前景的结果正在进行的研究仍在等待中,并且需要更长的随访时间来评估ADC对PCa的实际影响。
参考文献(上下滑动查看更多)
1.Rebecca L. Siegel, MPH; Kimberly D. Miller, MPH; Hannah E. Fuchs, BS; Ahmedin Jemal, DVM, PhD, Cancer statistics, 2022, CA Cancer J Clin 2022;72:7-33.
2.EAU guidelines: Prostate cancer - epidemiology and aetiology. (2022). Accessed: October 7, 2022;
3.Mariana Sardinha, Ana Filipa Palma dos Reis, João Vasco Barreira, Mário Fontes Sousa, Simon Pacey, Ricardo Luz, Antibody-Drug Conjugates in Prostate Cancer: A Systematic Review, Cureus 15(2): e34490.
4.Matthew I. Milowsky, MD, Matthew D. Galsky, MD, Michael J. Morris, MD, Daniel J. Crona, PharmD, PhD , Daniel J. George, MD, Robert Dreicer, MD, Kin Tse, BS, Jesika Petruck, BS, Iain J. Webb, MD, Neil H. Bander, MD, David M. Nanus, MD, and Howard I. Scher, MD, Phase 1/2 multiple ascending dose trial of the prostate-specific membrane antigen-targeted antibody drug conjugate MLN2704 in metastatic castration-resistant prostate cancer, Urol Oncol. 2016 December ; 34(12): 530.e15–530.e21.
5.Petrylak DP, Vogelzang NJ, Chatta K, et al.:PSMA ADC monotherapy in patients with progressive metastatic castration-resistant prostate cancer following abiraterone and/or enzalutamide: Efficacy and safety in open-label single-arm phase 2 study. Prostate. 2020, 80:99-108. 1
6.David M. Goldenberg, Rhona Stein and Robert M. Sharkey, The emergence of trophoblast cell-surface antigen 2 (TROP-2) as a novel cancer target, Oncotarget, 2018, Vol. 9, (No. 48), pp: 28989-29006
7.Jorge A. Carrasquillo, Bernard M. Fine, Neeta Pandit-Taskar, Steven M. Larson, Stephen E. Fleming, Josef J. Fox, Sarah M. Cheal, Joseph A. O’Donoghue, Shutian Ruan, Govind Ragupathi, Serge K. Lyashchenko, John L. Humm, Howard I. Scher, Mithat Gonen, Simon P. Williams, Daniel C. Danila, and Michael J. Morris, Imaging Patients with Metastatic Castration-Resistant Prostate Cancer Using 89Zr-DFO-MSTP2109A Anti-STEAP1 Antibody, J Nucl Med 2019; 60:1517–1523.
8.de Bono JS, Concin N, Hong DS, et al.: Tisotumab vedotin in patients with advanced or metastatic solid tumours (InnovaTV 201): a first-in-human, multicentre, phase 1-2 trial. Lancet Oncol. 2019, 7:383-393.
9.Mansfield AS, Hong DS, Hann CL, et al.: A phase I/II study of rovalpituzumab tesirine in delta-like 3- expressing advanced solid tumors. NPJ Precis Oncol. 2021, 5:74.






 个人中心
个人中心
 我是园区
我是园区




