Nat Commun丨米伟实验室揭示大肠杆菌调控脂多糖合成的分子机理
收藏
关键词:
机理揭示Nat
资讯来源:BioArt + 订阅账号
发布时间:
2022-08-11

脂多糖
(
LPS
)
是大多数革兰氏阴性细菌一种必需的糖脂。它位于细胞外膜的外叶面,起到保护性屏障的作用。在大肠杆菌中,如果LPS含量太多或者太少对细胞都是有害的。所以LPS 水平受到精密的反馈控制。在大肠杆菌中,细胞内LPS的含量是由脱乙酰酶
LpxC
决定。而LpxC的蛋白含量调节是通过细胞膜上的蛋白酶FtsH 介导的降解来实现。FtsH是大肠杆菌的一种必需的AAA+蛋白酶。它的底物除了LpxC之外,还有其他多达二十种的可溶蛋白和膜蛋白。但几十年来,大肠杆菌如何根据细胞内 LPS 的水平特异性调节 FtsH 蛋白酶对 LpxC 的降解,但不影响其他 FtsH 底物的降解一直是个谜。
近些年来,多个课题组通过遗传学实验,发现了两个以前功能未知的膜蛋白,LapB和YejM参与了蛋白酶FtsH对LpxC的调控:其中LapB能促进LpxC的降解,而YejM则抑制LpxC的降解。但人们并不清楚这两个膜蛋白参与调控LpxC降解的具体分子机理。
2022年8月5日,耶鲁大学药理系助理教授米伟课题组在Nature Communications在线发表了题为“
Regulatory mechanisms of lipopolysaccharide synthesis in Escherichia coli
”的研究论文,
揭示了大肠杆菌调控LPS合成的分子机理。
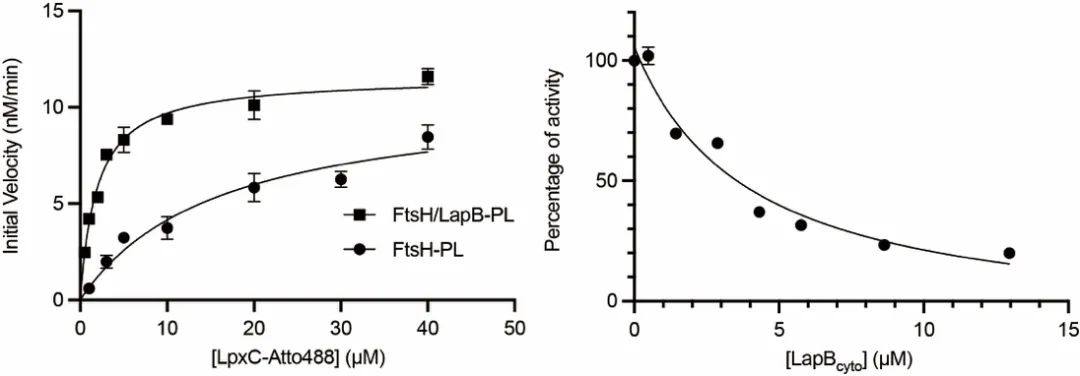
为了了解 LapB 如何促进 FtsH 介导的 LpxC 降解,米伟实验室博士后舒盛等设计了一个灵敏的定量实验来研究LpxC降解的酶促反应动力学。他们首先用荧光标记了底物LpxC,在与蛋白酶FtsH反应后,加入三氯乙酸沉淀掉未被降解的LpxC,然后测量上清液中的荧光信号。为了模拟细胞中的生物膜环境,舒盛等还将蛋白酶FtsH和LapB组装到脂质体中。Michaelis–Menten曲线显示:LapB显著地降低LpxC降解的Michaelis常数Km,而几乎对最大反应速率Vmax影响很小。这显示LapB起到配体蛋白的作用,能促进蛋白酶FtsH和底物LpxC的亲和力。接下来舒盛等通过体外的生化实验进一步证明:LapB通过跨膜螺旋与蛋白酶FtsH相互作用,通过胞内结构与募集底物LpxC。
为了研究YejM如何抑制FtsH介导的 LpxC 降解,舒盛等解析了YejM/LapB复合物的单颗粒冷冻电镜结构。冷冻电镜结构显示YejM的跨膜结构域包裹LapB的跨膜螺旋,这意味着当YejM与LapB形成复合物后,LapB将不能与蛋白酶FtsH相互作用,从而实现YejM对FtsH介导的 LpxC 降解的抑制作用。通过比较YejM/LPS复合物的晶体结构和YejM/LapB复合物的电镜结构,米伟实验室还发现LapB和LPS在YejM上的结合位点有重叠。这说明细胞内膜上高浓度的LPS可能破坏YejM/LapB复合物,从而释放YejM对FtsH介导的 LpxC 降解的抑制作用。通过体外的降解实验,米伟实验室证明:脂质体中高浓度的Kdo2-LipidA
(LPS的前体)
的确能释放YejM对FtsH介导的 LpxC 降解的抑制作用。
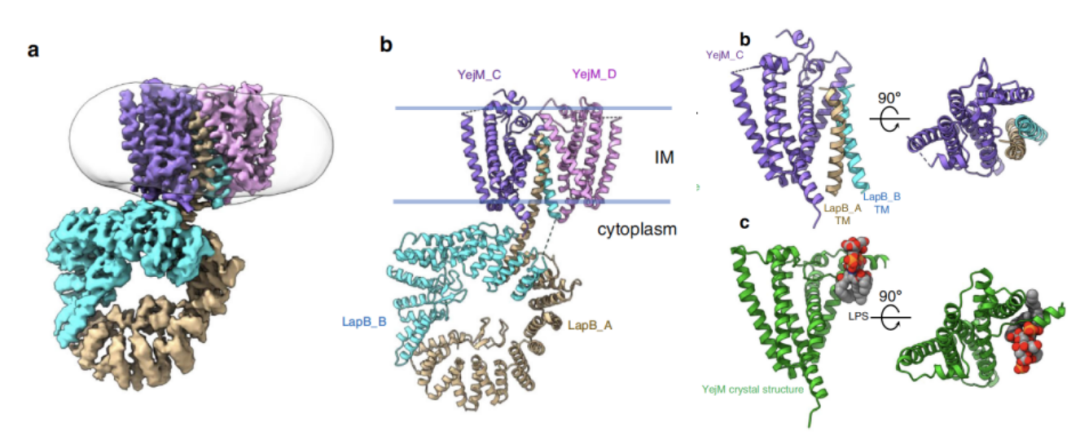
最后米伟实验室提出了一个大肠杆菌调控LPS合成的模型:当大肠杆菌快速生长时,细胞外膜需要大量的LPS,这时候细胞内膜上LPS的含量很少。YejM与LapB形成复合物,蛋白酶FtsH降解LpxC的速率很低,LpxC含量维持在较高水平。高浓度的LpxC能催化合成大量的LPS。当细胞生长进入平台期后,细胞外膜需要的LPS减少。大量的LPS富集在细胞内膜上,从而破坏YejM/LapB复合物。因此配体蛋白LapB能与蛋白酶FtsH结合,促进LpxC的降解。细胞中LpxC的减少导致LPS合成减少。
该研究论文的第一作者是博士后舒盛,通讯作者为耶鲁大学药理系助理教授米伟。目前米伟实验室正在招聘中,欢迎具有微生物遗传学,细胞成像,或者质谱背景的优秀博士或者学生联系米伟教授投递简历。
https://jinshuju.net/f/ZqXwZt
或扫描二维码
投递简历
https://www.nature.com/articles/s41467-022-32277-1
制版人:十一
【非原创文章】本文著作权归文章作者所有,欢迎个人转发分享,未经作者的允许禁止转载,作者拥有所有法定权利,违者必究。







 药选址
药选址






