据
Insight 数据库
统计,本周(7月 10 日-7 月 16 日)全球共有 34 款创新药(含改良新)研发进度推进到了新阶段,其中,5 款申报临床,6 款首次获批临床。从成分类别角度来看,化药有 16 款,占比约 47%;此外,还涉及单抗、ADC、核酸药物等。
下面,Insight 将分别摘取国内外部分重点项目做介绍。
国内方面,本周共有 21 款创新药研发进度推进到了新的阶段,其中,首次获批上市 1 款,首次申报上市 2 款。
首次公示临床试验的
有
9
款,包括 8
款国产,
1
款进
口,
其中,恒瑞有 3 款产品在本周首次启动临床。
来自:
Insight 数据库网页版
(http
://db.dxy.cn/v5/home/)
先声药业:首款骨髓保护 CDK4/6 抑制剂获批上市
7 月 13 日,
先声药业的 CDK4/6 抑制剂「注射用曲拉西利」在中国上市,用于化疗骨髓保护。据 Insight 数据库显示,这款新药 2021 年 12 月才申报上市,如今仅 7 个月就获得批准,速度相当快(>>
点此回顾审评历程
)。
曲拉西利(Trilaciclib)是先声药业在 2020 年 8 月以总计 1.7 亿美元从 G1 Therapeutics 引进的产品,是全球首个且唯一具有全面骨髓保护功效的药物,曾获 FDA 突破性疗法认定和优先审评资格,并于 2021 年 2 月在美国获批上市(商品名:COSELA™)。
作为一种细胞周期蛋白依赖性激酶 4/6(CDK4/6)抑制剂,曲拉西利可以将骨髓中的造血干/祖细胞等暂时地阻滞在细胞周期的 G1 期,让细胞暂时停止分裂,从而免受化疗药物的杀伤。
2021 年 2 月,曲拉西利 获 FDA 批准上市。这项批准基于 3 项双盲、安慰剂对照 II 期临床试验,共纳入 235 例广泛期小细胞肺癌患者,接受抗肿瘤治疗的同时分别随机接受曲拉西利或者安慰剂治疗,其中化疗方案分别为依托泊苷+卡铂一线治疗、依托泊苷+卡铂+阿替利珠单抗一线治疗、拓扑替康二/三线治疗。
曲拉西利针对小细胞肺癌患者的 3 项 II 期临床数据
来自:
Insight 数据库网页版
(http
://db.dxy.cn/v5/home/)
结果显示,曲拉西利降低 49% 的严重中性粒细胞减少发生率(发生率 63% VS 14%),减少了集落刺激因子的使用率(67% VS 35%)。而在出现严重中性粒细胞减少的患者中,接受曲拉西利治疗的患者症状持续时间也更短。此外,针对三阴乳腺癌患者,G1 Therapeutics 也开展了临床试验,目前
也有相应临床结果公布。
在国内,根据 Insight 数据库,自 2020 年 8 月先声引进这款产品之后,同年 11 月即提交临床申请,迄今已经获批 3 项临床试验申请,并且启动了曲拉西利针对小细胞肺癌、结直肠癌、三阴性乳腺癌三项适应症的 III 期临床试验。
2021 年 11 月,先声药业宣布注射用曲拉西利(Trilaciclib)已向 NMPA 递交新药上市申请 并获受理。本次获批之后,曲拉西利成为国内企业获批的第 2 款 CDK4/6 抑制剂,不过适应症与其他同靶点产品的差异性,上市后不必面对 CDK4/6 靶点领域的激烈竞争。
首次申报上市
7 月 13 日,再鼎医药宣布 efgartigimod 的上市申请获 CDE 受理,用于治疗全身型重症肌无力 (MG)。这是全球首款且目前唯一获 FDA 批准上市的 FcRn 抑制剂,也是首个获批的通过内源性减少致病性抗体而专门治疗全身型 MG 的疗法。
efgartigimod 是由 argenx 公司开发的一种针对抗体介导自身免疫疾病的、高度靶向免疫球蛋白 (IgG) 新型治疗药物。2021 年 1 月,再鼎医药与 argenx 达成独家授权合作,负责 efgartigimod 在大中华区的开发和商业化工作,交易总额为 1.75 亿美元。
据 Insight 数据库显示,
efgartigimod
于
2021 年 12 月获 FDA 批准上市
,用于治疗乙酰胆碱受体(AChR)抗体阳性的成人全身型重症肌无力。
此后,又于 2022 年 1 月在日本获批,用于治疗对类固醇或非类固醇免疫抑制疗法(ISTs)没有充分应答的全身型重症肌无力成人患者。
来自:
Insight 数据库网页版
(http
://db.dxy.cn/v5/home/)
此前,披露了一项有关 efgartigimod 的关键性 III 期 ADAPT 临床研究(登记号:NCT03669588)数据。研究主要终点为重症肌无力活动评分(MG-ADL)达到缓解(连续 4 周或以上至少改善 2 分)的 AChR-Ab + 患者数量。
该研究共入组 167 名成人 gMG 患者,并以 1:1 的比例随机分配接受 efgartigimod 或安慰剂,共治疗 26 周。结果显示达到主要研究终点:在乙酰胆碱受体抗体阳性(AChR Ab+)的 gMG 患者中,根据重症肌无力日常生活活动(MG-ADL)评分,与安慰剂组相比,efgartigimod 治疗组有更高比例的患者为应答者(67.7% vs 29.7%;p<0.0001)。应答者被定义为在 MG-ADL 评分上至少有 2 分的改善,且连续 4 周或更长时间。
此外,efgartigimod 治疗组有 40% 的患者实现了微小状态表达(定义为 MG-ADL 评分为 0 [无症状] 或 1),而安慰剂组实现这一目标的患者比例仅为 11.1 %。在 AChR-Ab+ 应答者中,84.1% 的患者在治疗的头 2 周内 MG-ADL 评分有临床意义的改善。而在安全性方面,研究显示,efgartigimod 治疗组与安慰剂相当。
来自:
Insight 数据库网页版
(http
://db.dxy.cn/v5/home/)
据 Insight 数据库显示,再鼎医药还在拓展 efgartigimod 其他适应症。当前正在开展针对免疫性血小板减少症、慢性炎性脱髓鞘性多发性神经病的 III 期临床研究,此外,efgartigimod 用于天疱疮以及特发性炎症性肌病的研究也已进入临床阶段。
新适应症报上市
亚盛医药:奥雷巴替尼新适应症报上市!拟纳入优先审评
7 月 11 日,亚盛药业的 1 类新药奥雷巴替尼新适应症申报上市拟纳入优先审评,用于治疗一代和二代酪氨酸激酶抑制剂(TKIs)耐药和/或不耐受的慢性髓细胞白血病(CML)慢性期(CP)患者。
奥雷巴替尼是中国首个、也是目前唯一一款三代 Bcr-Abl 抑制剂
,
可有效抑制 Bcr-Abl 酪氨酸激酶野生型及多种突变型的活性。
据 Insight 数据库 显示,奥雷巴替尼已于 2021 年 11 月在国内首次获批上市,成为国内首个获批伴有 T315I 突变的慢性髓细胞白血病适应症的药品,为因 T315I 突变导致耐药的患者提供了有效的治疗手段。
而本次申报的是一项新适应症,用于治疗一代和二代酪氨酸激酶抑制剂(TKIs)耐药和/或不耐受的慢性髓细胞白血病(CML)慢性期(CP)患者。据 Insight 数据库 显示,亚盛医药正在开展一项随机、开放、关键性 2 期研究,旨在评价奥雷巴替尼用于治疗该适应症的有效性和安全性(登记号:CTR20191420)。目前,该研究已完成全部受试者的入组工作。
来自:
Insight 数据库网页版
(http
://db.dxy.cn/v5/home/)
2021 年 7 月,亚盛医药与信达生物达成合作共同开发和商业化该产品,自上市以来,奥雷巴替尼的销售成绩优秀。据此前亚盛医药披露的年报数据显示,截至 2022 年 2 月底,奥雷巴替尼实现累计开票金额为人民币 5041 万元(未经审计含增值税金额)。奥雷巴替尼是亚盛医药的首个商业化产品,此次新适应如能顺利获批,无疑将更进一步助力亚盛医药的营收。
进口新药国内启动 III 期临床
礼来:口服 SERD 国内启动 III 期临床
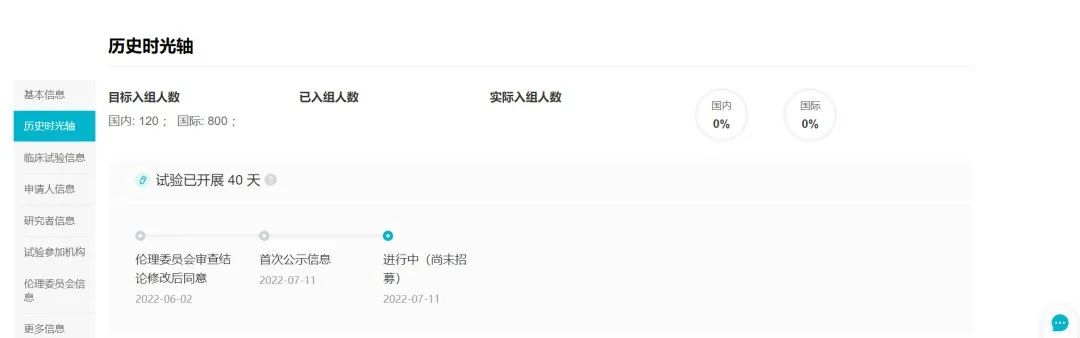
7 月 11 日,据 Insight 数据库显示,礼来的口服雌激素受体降解剂 Imlunestrant 首次在国内登记启动临床(>>点此查看临床试验详情)。
这是全球多中心 III 期临床试验 EMBER-3 研究的中国部分,国内拟入组 120 人,旨在比较 Imlunestrant 和研究者选择的内分泌治疗相比、以及 Imlunestrant 联合阿贝西利相较于 Imlunestrant 单药治疗 ER+/HER2- 局部晚期或转移性乳腺癌患者的 PFS 是否改善。
来自:Insight 数据库网页版(http://db.dxy.cn/v5/home/)
(点击放大,可查看大图)
Imlunestrant 研发代号为 LY-3484356,据 Insight 数据库显示,2019 年 11 月该药首次在国外启动临床,而
EMBER-3 研究最早在 6 月 7 日在国外监管机构登记
。
 来自:Insight 数据库网页版(http://db.dxy.cn/v5/home/)
来自:Insight 数据库网页版(http://db.dxy.cn/v5/home/)
(点击放大,可查看大图)
1、恒瑞:HRS-1167、HR19024、HRG2005
本周恒瑞HRS-1167、HR19024 以及 HRG2005 这 3 款产品均获首次启动临床。
据公开资料显示,恒瑞 HRS-1167 片可抑制肿瘤细胞增殖,发挥抗肿瘤作用。截至目前,HRS-1167 片相关项目累计已投入研发费用约 1,879 万元。
据 Insight 数据库显示,今年 5 月 12 日,恒瑞 HR19024、HRG2005 同时获批临床,分别用于晚期实体瘤、慢性阻塞性肺疾病
(
COPD
)
患者的维持治疗。
7 月 11 日,据 Insight 数据库显示,翰森制药 HS-10384 首次启动临床。HS-10384 于 2022 年 4 月,首次获批临床,用于更年期血管舒缩综合征。
当前正在开展一项评价 HS-10384 单次口服给药的安全性、耐受性、药代动力学的随机、双盲、安慰剂对照的 I 期临床试验(登记号:CTR20221693),目标入组人数 72 人。
来自:Insight 数据库网页版(http://db.dxy.cn/v5/home/)
(点击放大,可查看大图)
7 月 11 日,君实生物 WJ01075 首次启动临床,据 Insight 数据库显示,今年 1 月 20 日,君实 XPO1 抑制剂 WJ01075 片首次获批临床,用于晚期恶性肿瘤。这是君实进入临床开发的第 2 款 XPO1 抑制剂,在 2021 年 8 月,该公司首款 XPO1 抑制剂 WJ01024 已经启动 I 期临床。
来自:Insight 数据库网页版(http://db.dxy.cn/v5/home/)
(点击放大,可查看大图)
本周境外共
有 13 款新药(含改良新)研发进度推进到新阶段
,此外,III 期临床结果的公布也颇受关注。
来自:Insight 数据库网页版(http://db.dxy.cn/v5/home/)
(点击放大,可查看大图)
III 期临床结果
再生元/赛诺菲:Dupixent III 期临床结果积极
7 月 14 日,再生元(Regeneron)与赛诺菲(Sanofi)公布 Dupixent(dupilumab/度普利尤单抗)在 1 至 11 岁患有嗜酸性食管炎孩童中进行的临床 III 期试验(登记号:NCT04394351)结果积极。
本研究共纳入 102 名 1 至 11 岁的儿童,并被随机分配接受 Dupixent 治疗,根据体重采用较高剂量 (n = 37) 或较低剂量 (n = 31),或安慰剂 (n = 34)。结果显示,68% 的高剂量组和 58% 的低剂量组在 16 周治疗后都达到了显著的组织学疾病缓解主要终点,而安慰剂组仅为 3%。
而在安全性方便,与 12 岁及以上儿童和成人的 EoE 适应症中的安全性一致。
总体不良事件率 (AE) 为 79%,安慰剂为 91%。
更常见(≥ 5%)的 AE 包括 COVID-19、皮疹、头痛、病毒性肠胃炎、腹泻和恶心。
来自:
Insight 数据库网页版
(http
://db.dxy.cn/v5/home/)
据 Insight 数据库显示,Dupixent 此前已被批准用于治疗哮喘、特应性皮炎、慢性鼻窦炎伴鼻息肉病等多项适应症。
而对于嗜酸性食管炎已于今年 5 月获 FDA 批准上市,不过针对人群为成人和 12 岁及以上嗜酸性食管炎儿童。
来自:Insight 数据库网页版(http://db.dxy.cn/v5/home/)
(点击放大,可查看大图)
免责声明:本文仅作消息分享,不代表 Insight 立场和观点,也不作治疗方案推荐和介绍。如有需求,请咨询和联系正规医疗机构。
投稿:微信 insightxb;邮箱 insight@dxy.cn
免费试用 Insight 数据库









 来自:Insight 数据库网页版(http://db.dxy.cn/v5/home/)
来自:Insight 数据库网页版(http://db.dxy.cn/v5/home/)











 个人中心
个人中心
 我是园区
我是园区




