
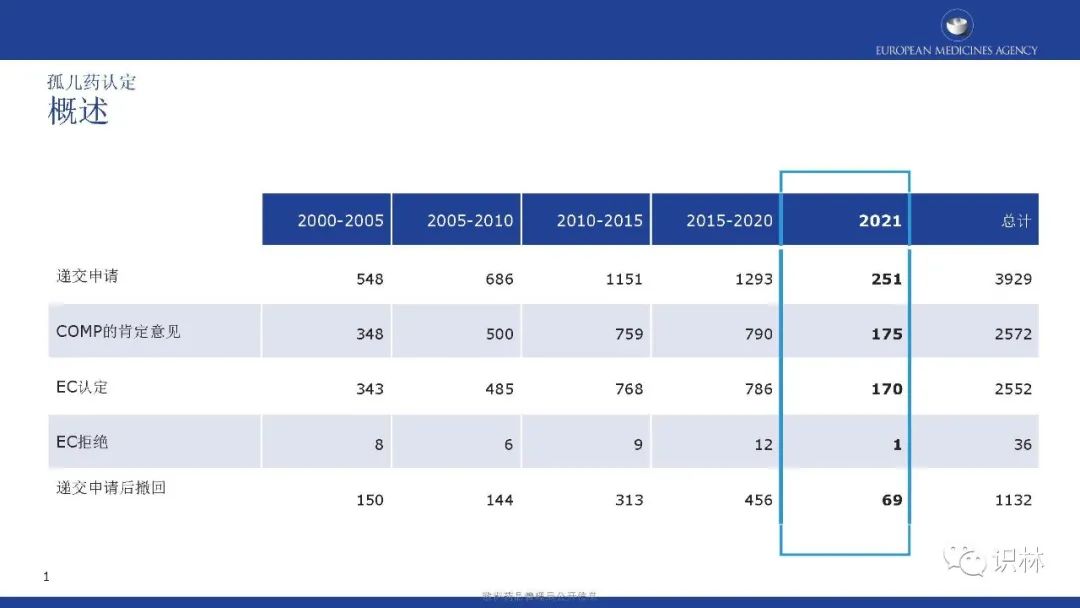
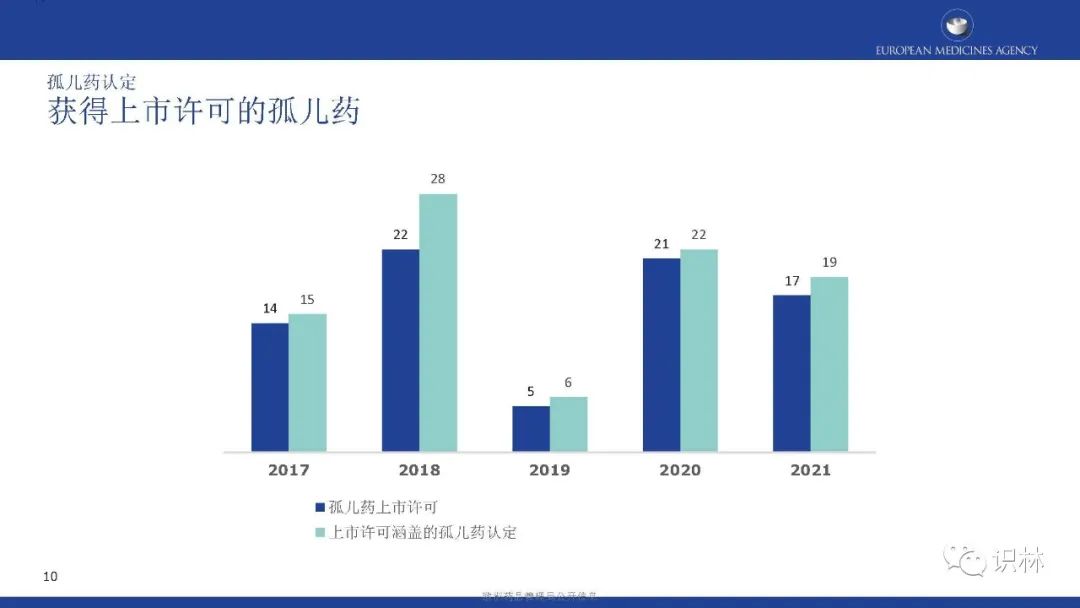
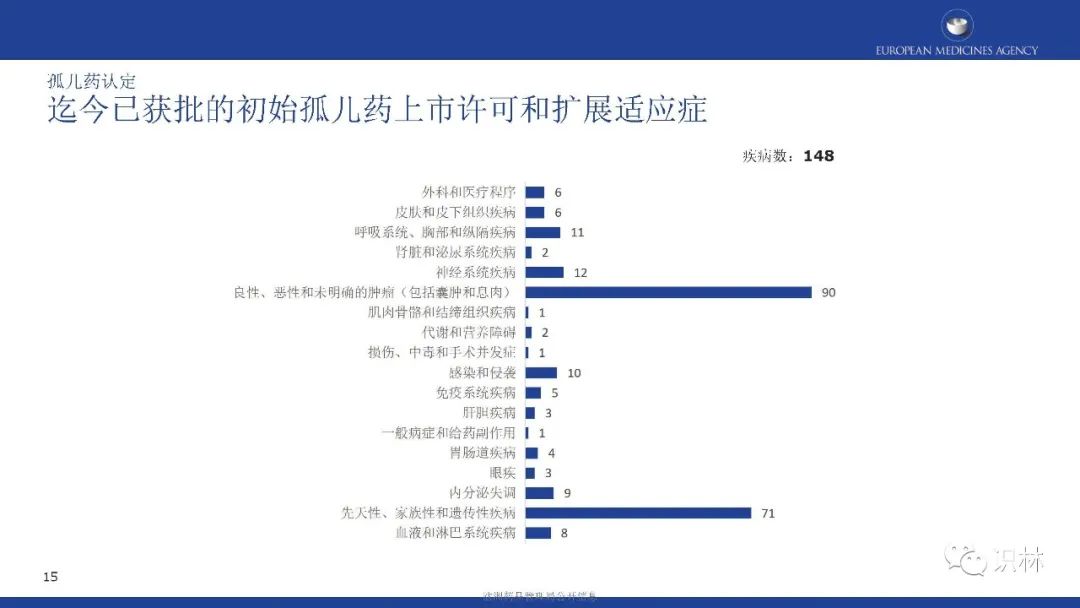
可以看到,自2000年欧盟孤儿药法规实施至2021年年底,欧盟共认定了2552个孤儿药,207个初始孤儿药申请,以及38个孤儿药扩展适应症获得上市许可。
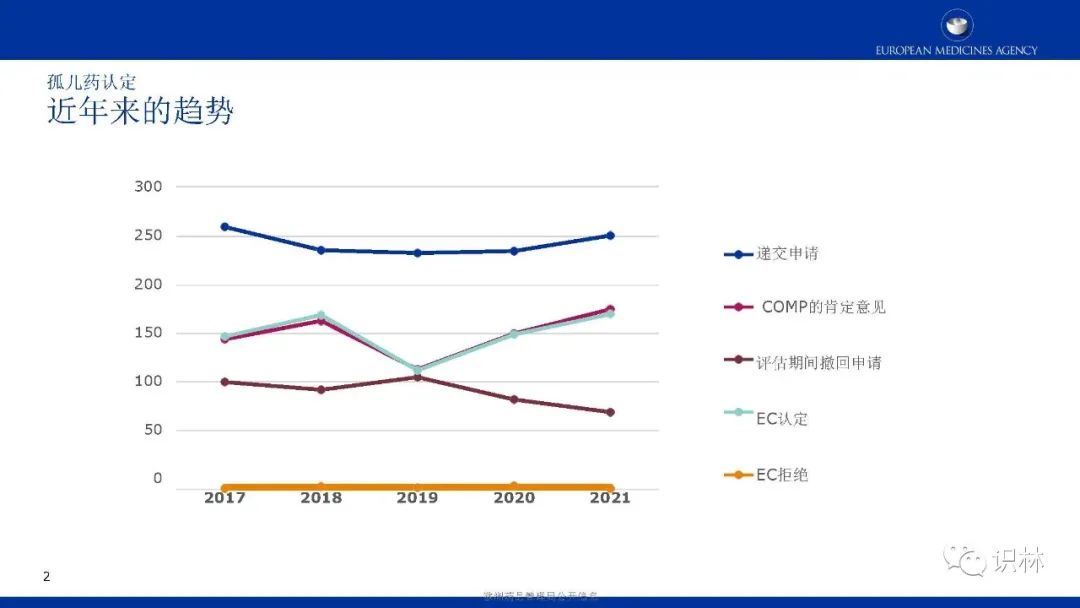
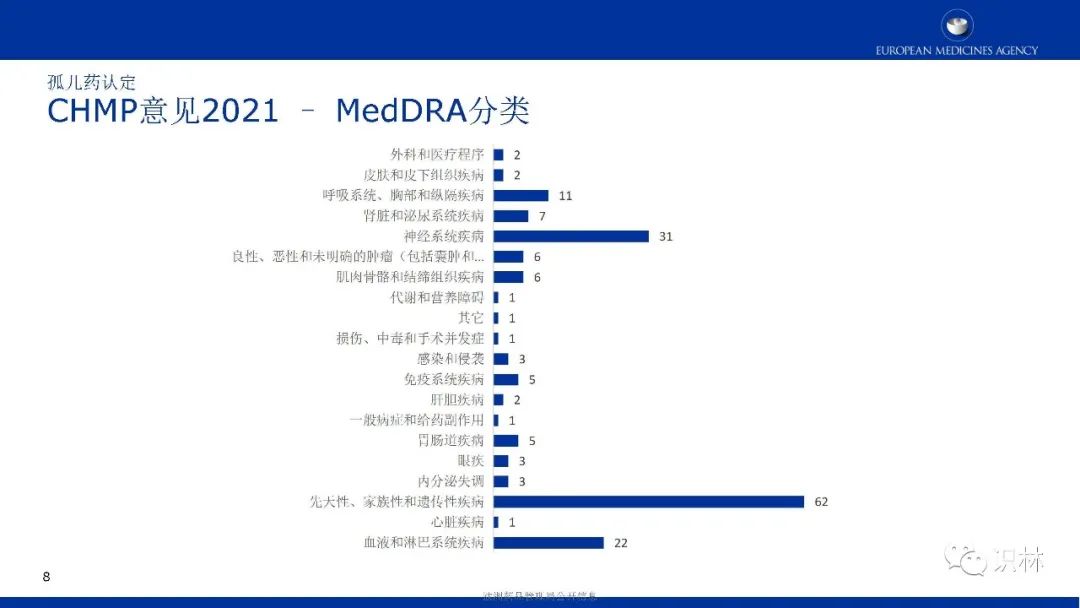
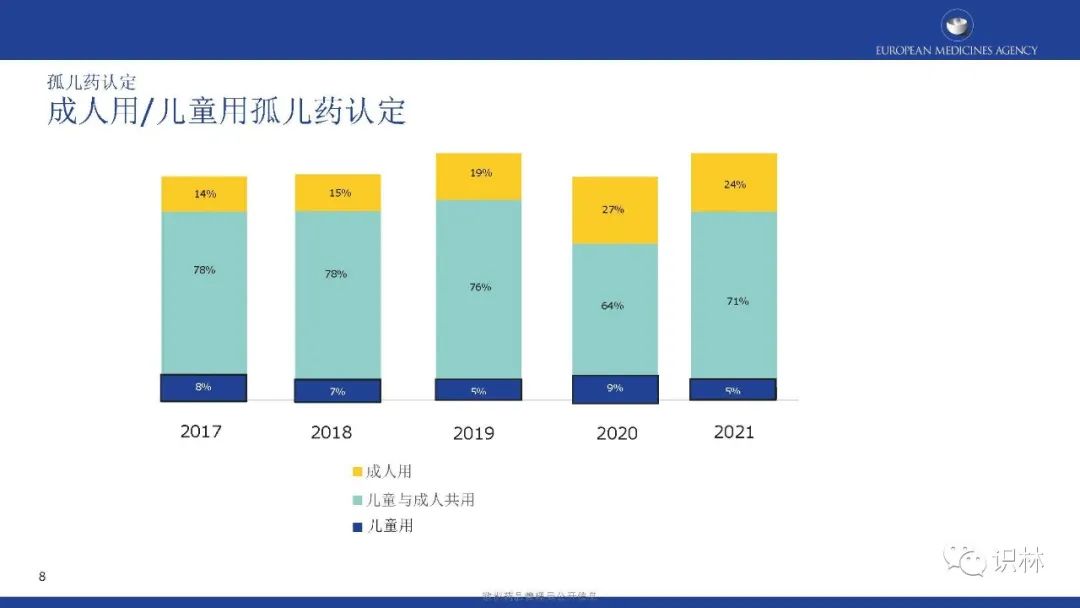
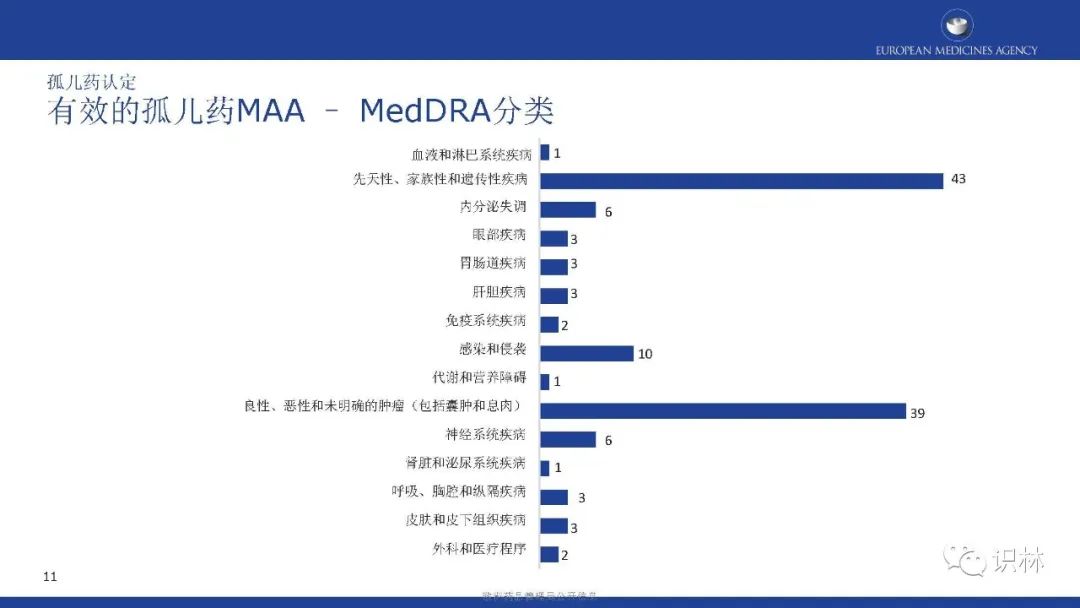
COMP的肯定意见和EC认定整体呈上升趋势。其中,绝大部分孤儿药认定有三个特点:基于显著获益、儿童与成人可共用、患病率0.01%-0.03%。在2021年,获认定孤儿药中,按疾病类别,先天性、家族性和遗传性疾病占比最高。
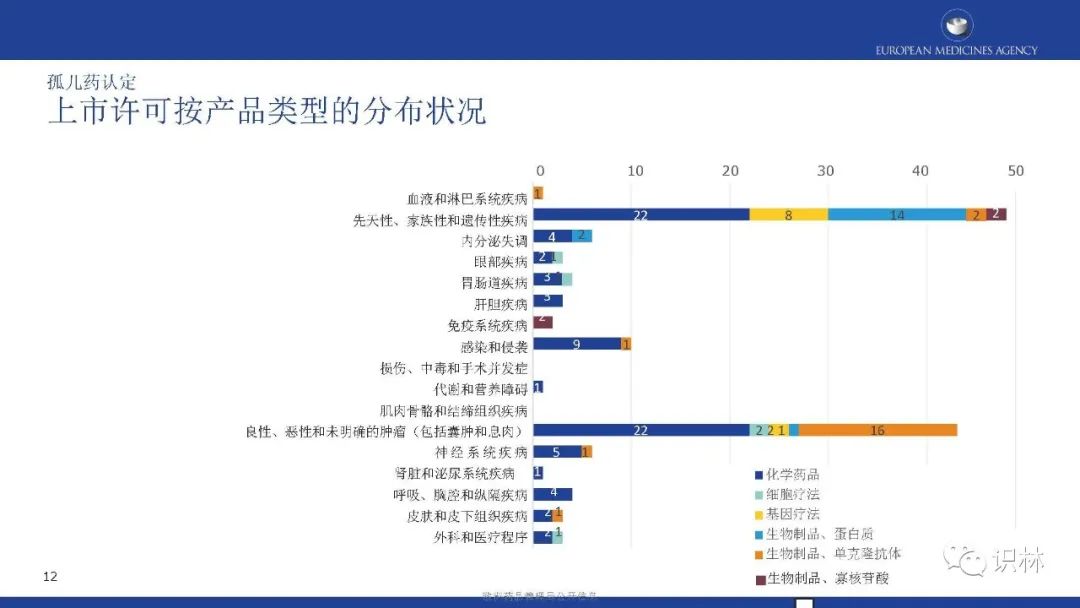
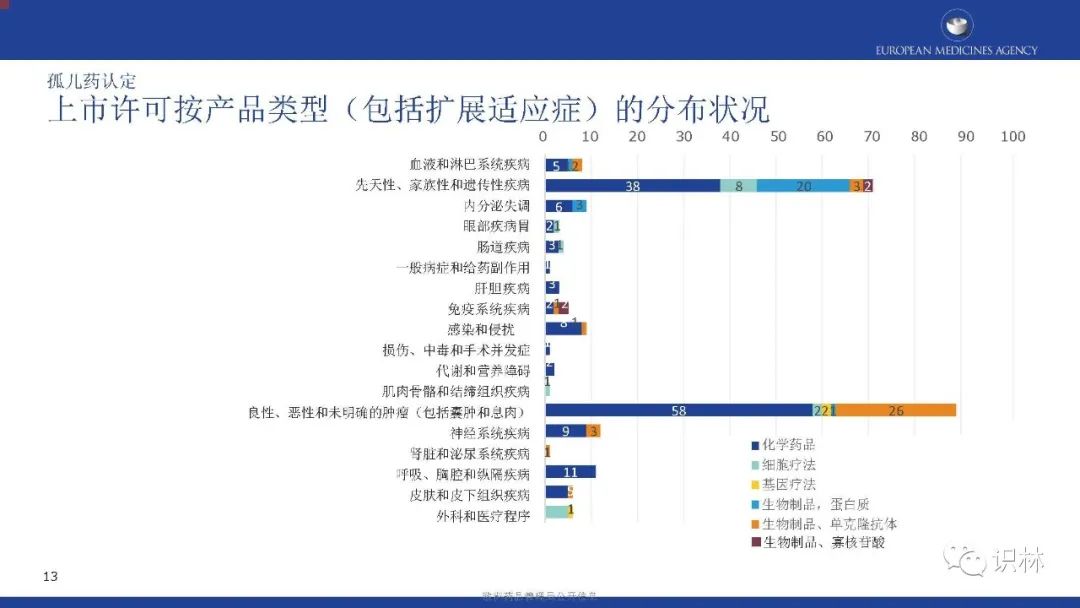
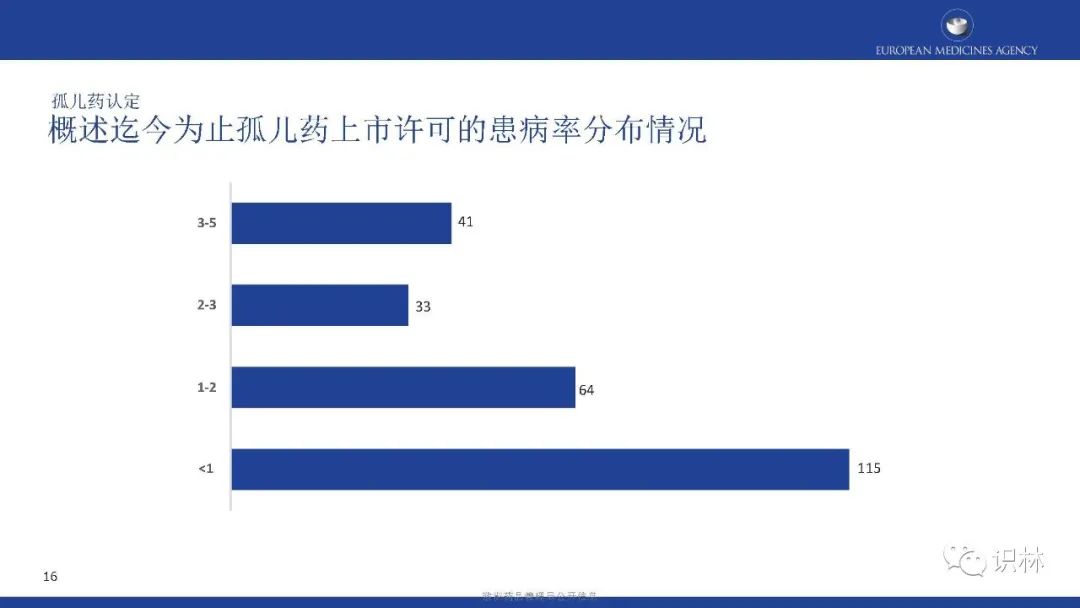
获得上市许可的孤儿药中,按产品类别,化学药品占比最高;按疾病类别,先天性、家族性和遗传性疾病占比最高。
孤儿药,或者说孤儿药适应症,可能是许多国产创新药迈向全球市场、取得突破的一步好棋,识林将ppt全文翻译(见文末),供有志于此的企业用户参考。
原文可至识林检索,也可以阅读主题词【孤儿药】,系统性了解全球主要监管机构的法规指南。
此外,也可阅读识林相关资讯,如【欧盟发布对孤儿药和儿科用药法规的全面评估报告】和【欧盟孤儿药和儿科用药法规修订拟议遭业界反对】
部分名词解释
EC(European Commission,欧洲委员会):是欧盟的常设执行机构,也是欧盟唯一有权起草法令的机构。EC可根据COMP的正面意见授予孤儿药认定。
COMP(Committee for Orphan Medicinal Products,孤儿药委员会):负责审评用于诊断、预防或治疗罕见疾病的药物的孤儿药认定申请。
CHMP(Committee for Medicinal Products forHuman Use,人用医药产品委员会):负责准备EMA对有关人用药物的所有问题的意见。
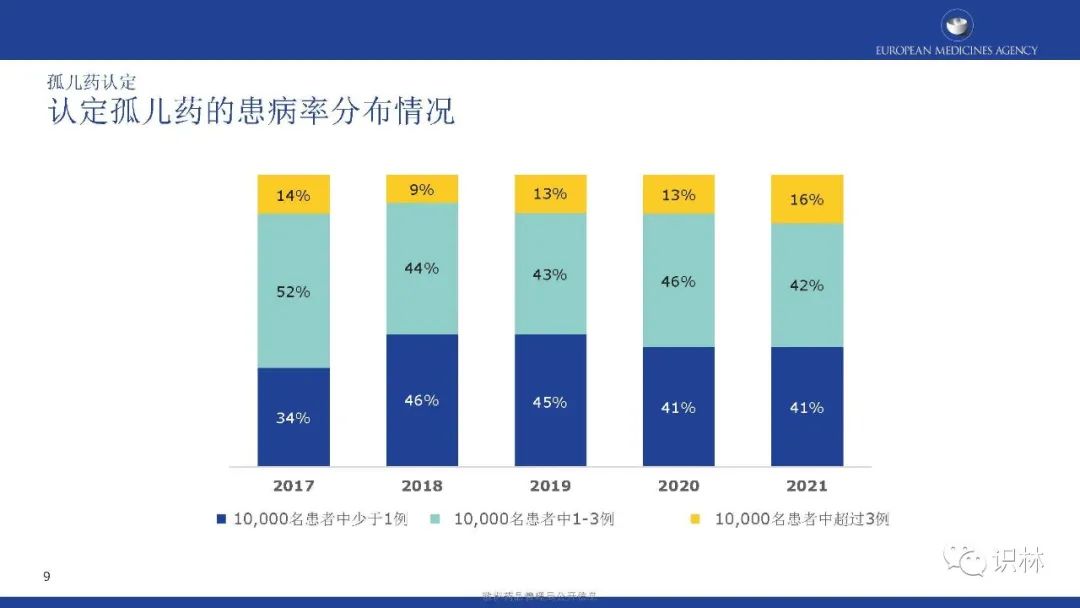
孤儿药认定标准:在欧盟,孤儿药的认定基于孤儿药法规制定的标准。获得孤儿药认定资格,需满足以下条件:1)严重性:必须用于治疗、 预防或诊断危及生命或慢性衰弱的疾病。2)患病率:在欧盟的患病率不超过0.05%或药品上市销售收入无法匹敌其研发所需的投入。3)显著获益:目前没有令人满意的诊断、预防或治疗相关疾病的方法获批,或存在这样的方法,但相关药物的显著获益受到相关疾病的影响。孤儿药认定的标准在国际上并不统一,如已在美国或日本获得孤儿药认定,在欧盟不会自动获得孤儿药认定。
ATMP(Advanced Therapy Medicinal Product,前沿治疗药物):是指主要运用基因(核酸)、细胞、人体组织来治疗疾病,并可批量化生产的创新性药物及医药产品。EMA认为,ATMP对于严重的、目前尚无法治疗的以及慢性疾病尤为重要,传统医疗对于这些领域的治疗已经显示了其自身局限性。为此,EMA一直积极地推动ATMP的开发,但ATMP的部分治疗功能仍处于临床研究阶段,该类产品的安全性和有效性数据还不够充分,有待进一步研究和确证。
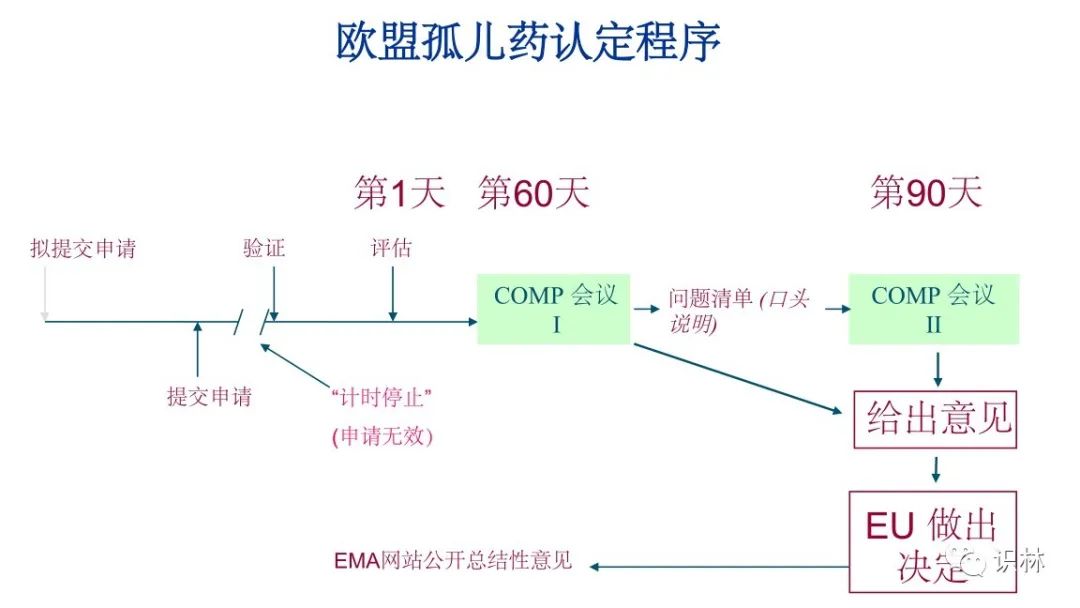
孤儿药认定程序
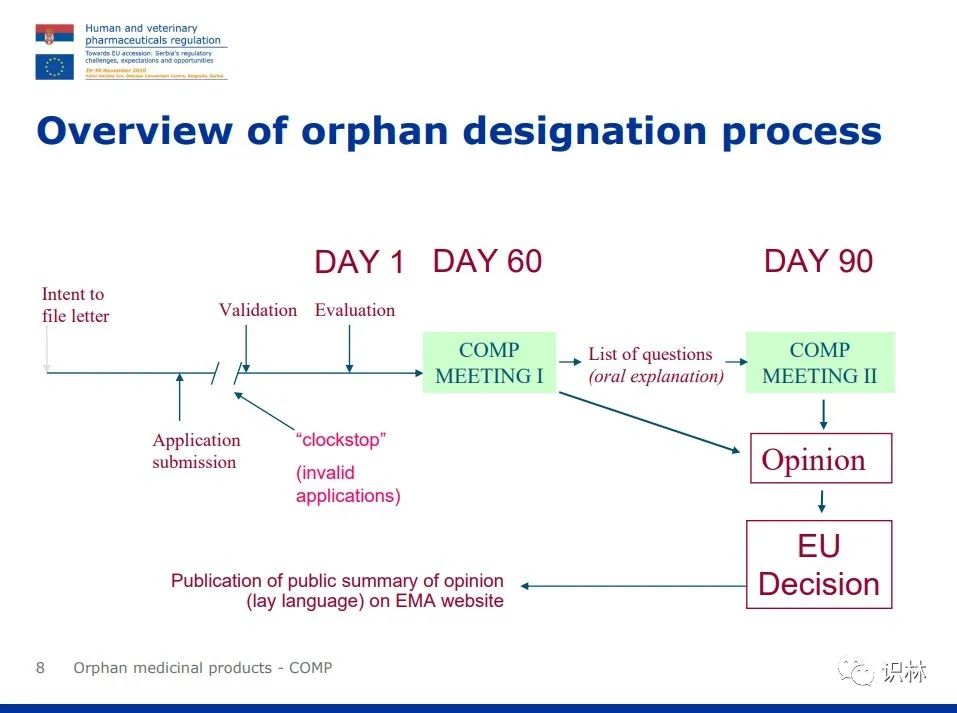
上图来自:https://www.ema.europa.eu/en/documents/presentation/presentation-orphan-medicinal-products-activities-committee-orphan-medicinal-products-comp_en.pdf

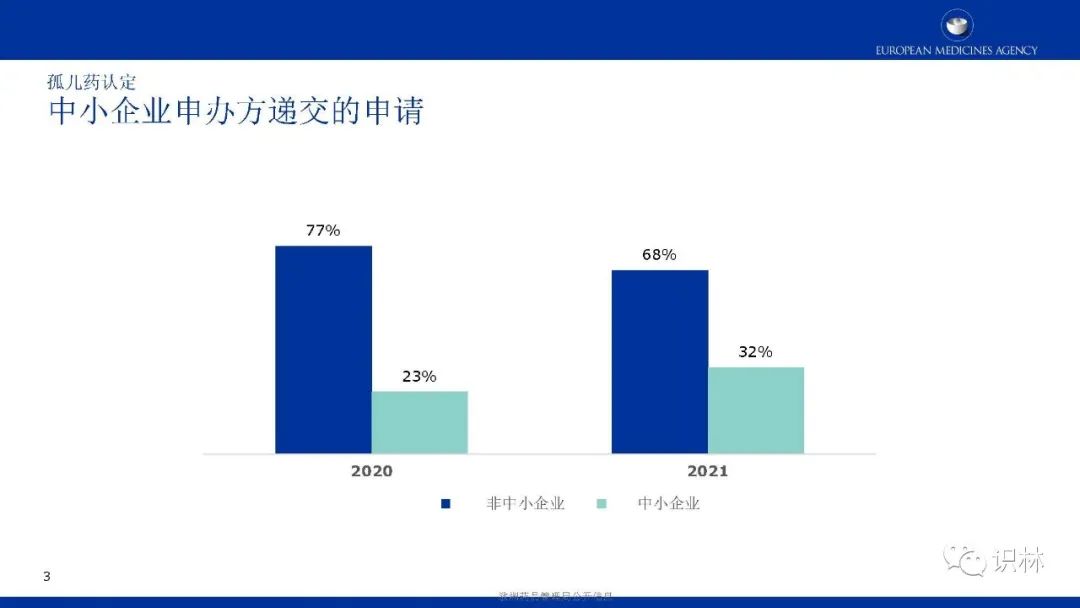
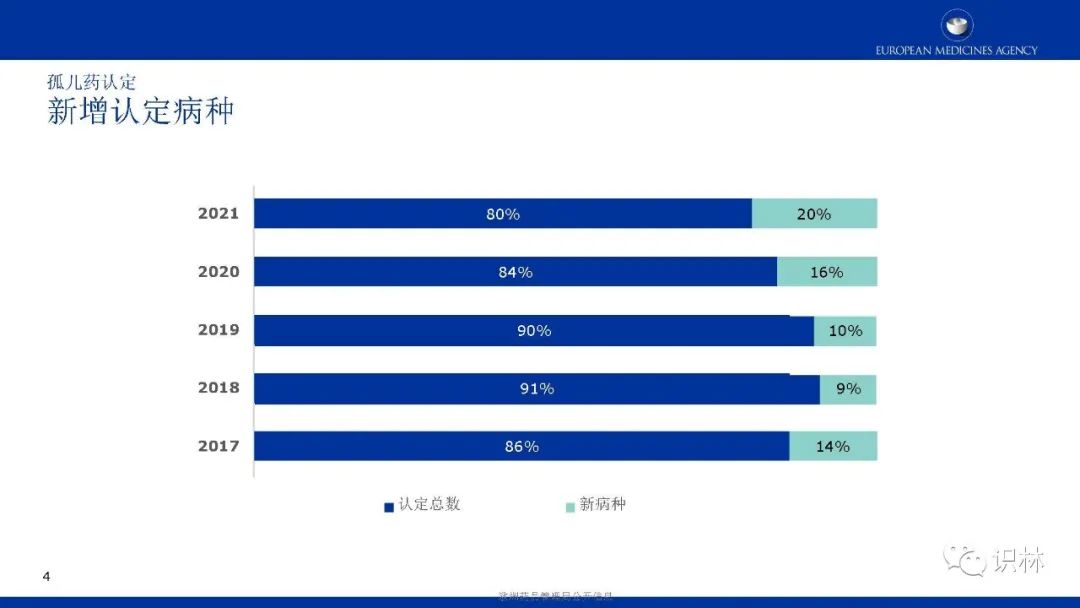
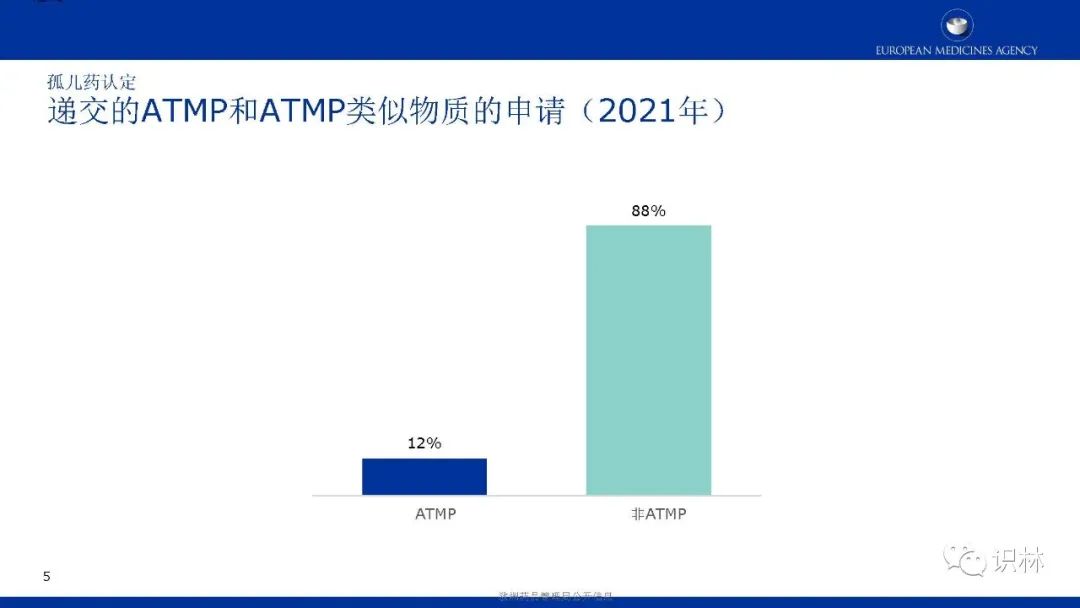
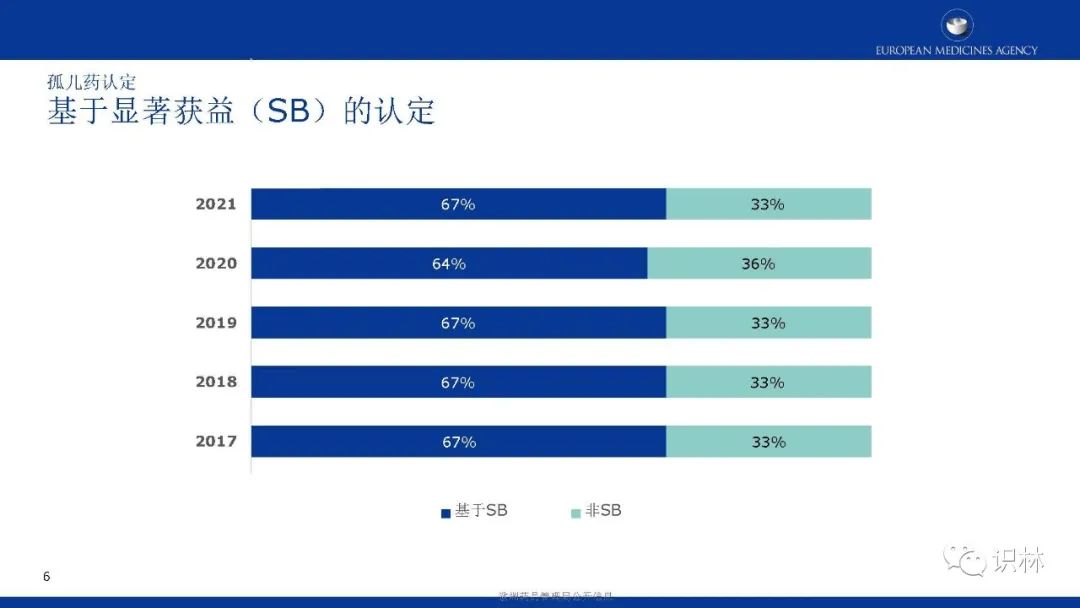




长按下方二维码下载识林®App

识林®版权所有,未经许可不得转载。



 个人中心
个人中心
 我是园区
我是园区




