
11 月 17 日,歌礼制药宣布自主研发的口服 PD-L1 小分子抑制剂 ASC61 已经获批临床,用于治疗晚期实体瘤。当前,ASC61 美国 I 期剂量递增研究正在有序进行,中国 IND 获批将加速 ASC61 全球开发。
截图来
自:Insight 数据库网页版
(http://db.dxy.cn/v5/home/)
ASC61 是一款口服小分子抑制剂前药。
其活性代谢物 ASC61-A 是一款强效、高选择性的抑制剂,通过诱导 PD-L1 二聚体的形成和内吞,从而阻断 PD-1/PD-L1 的相互作用。
ASC61 单药在人源化小鼠模型等多种动物模型中表现出显著的抗肿瘤疗效。临床前研究显示,ASC61 在动物模型中有良好的安全性和药代动力学特徵。
在一项头对头比较、使用人类 PD-L1 表达细胞和新鲜外周血单个核细胞 (PBMCs) 共培养的实验中,ASC61-A 治疗可诱导分泌 IFNγ 且呈现出浓度依赖型,半最大效应浓度 EC50 为 2.86 nM。ASC61-A 诱导的 IFNγ 最大水平与已上市 PD-1 抗体可瑞达 (Keytruda) 诱导的 IFNγ 相似。
与 PD-1/PD-L1 抗体注射剂相比,口服 PD-L1 抑制剂 ASC61 具有以下优势:
(1) 给药方便安全,无需去医院注射,患者依从性更高;
(2) 容易与其他口服抗肿瘤药物组成全口服联合治疗方案;
(3) 给药剂量灵活,可以更好地管理免疫相关不良事件;
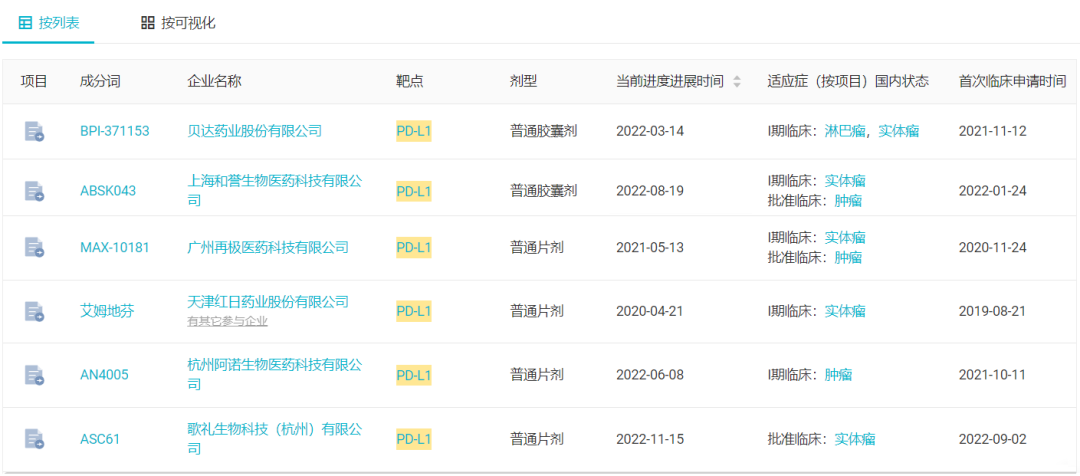
据 Insight 数据库显示,当前国内已有 6 款口服 PD-L1 小分子抑制剂进入了临床开发
,最高处于临床 I 期。其中最早的是红日药业的艾姆地芬,早在 2019 年度就申请临床,2020 年 4 月启动 I 期临床,不过暂无进一步动向。目前,贝达药业的 BPI-371153、和誉医药的 ABSK043、阿诺生物的 AN4005、再极医药的 MAX-10181 也均处于 I 期临床,歌礼的加入又为这一赛道增添了一位潜力选手。
国内临床阶段 PD-L1 小分子抑制剂及其进度
此外,复星医药的 FGFR/VEGFR 双靶点新药 FH-2001 今年初也启动了 I 期临床,该药的抗癌疗效也通过调节 PD-L1 表达、抑制 FGFR 双重机制来实现。
国内 PD-(L)1 赛道已经从最初的「PD-1 单抗热」开始拓展延伸。剂型上,有开发口服小分子抑制剂者,也有开发皮下注射剂者;成分类别上有开发双特异性抗体者,也有开发单抗联合疗法者,百花齐放。未来能否从中诞生出疗效亮眼、给药便利的明星药?值得进一步关注和期待。
免责声明:本文仅作消息分享,并不构成投资建议,也不代表 Insight 数据库的立场,文章观点仅供分享行业见解,请广大投资者谨慎。
投稿:微信 insightxb;邮箱 insight@dxy.cn
Insight 数据库网页版等你体验
点击阅读原文,立刻解锁!






 药选址
药选址




