您还不是认证园区!
赶快前去认证园区吧!
本文转载自Insight数据库


来自 Insight 数据库
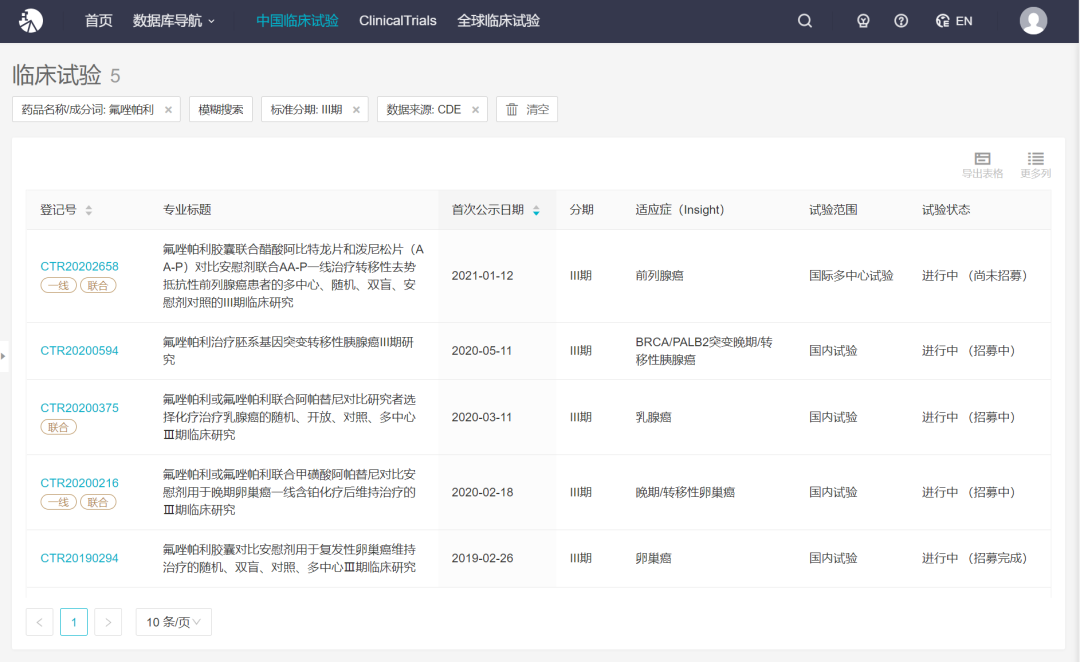
氟唑帕利是一种聚腺苷二磷酸核糖聚合酶(poly(ADP-ribose)polymerase,PARP)抑制剂,可特异性杀伤 BRCA 突变的肿瘤细胞。经查询,氟唑帕利目前国外有同类产品 Olaparib(商品名 Lynparza)、Rucaparib(商品名 Rubraca)、Niraparib(商品名 Zejula)和 Talazoparib(商品名 Talzenna)于美国获批上市销售,Olaparib(商品名 Lynparza)于 2018 年 8 月在中国获批上市,商品名为利普卓。国内再鼎医药的甲苯磺酸尼拉帕利胶囊(商品名则乐)于 2019 年 12 月在中国获批上市,用于铂敏感的复发性上皮性卵巢癌、输卵管癌或原发性腹膜癌成人患者在含铂化疗达到完全缓解或部分缓解后的维持治疗。
2019 年 Olaparib(商品名 Lynparza)、Rucaparib(商品名 Rubraca)、Niraparib(商品名 Zejula)和 Talazoparib(商品名 Talzenna)全球销售额约为 13.57 亿美元,美国销售额约为 6.74 亿美元。截至目前,氟唑帕利相关项目累计已投入研发费用约为 31,405 万元。
目前,该临床试验已在中国、美国获批开展,根据恒瑞披露,后续其还将计划在澳洲、欧洲、韩国、中国台湾等国家及地区申请开展国际多中心临床试验。



 个人中心
个人中心
 我是园区
我是园区




