
艾滋病毒 (HIV-1) 和宿主免疫系统一直处于战争状态,在这一过程中病毒和宿主共同进化,宿主细胞进化出了多种复杂的防御机制来对抗病毒感染,而病毒也进化出了多种逃逸机制来拮抗宿主的先天免疫系统。HIV-1编码四个辅助蛋白 (Vif, Vpu, Nef, 和Vpr) ,其中Vif, Vpu和Nef可通过对抗不同的宿主限制因子APOBEC3G, Tetherin,和SERINC5帮助病毒逃逸宿主细胞的免疫限制作用,已分别于2002年,2008年和2015年先后被国外研究团队破解,而Vpr帮助病毒逃逸宿主限制的具体机制尚未阐明。
近日,中国医科大学尚红院士团队的梁国新教授课题组在Nature Communications发表题为Vpr counteracts the restriction of LAPTM5 to promote HIV-1 infection in macrophages 的文章,该研究首次鉴定了髓系细胞(巨噬细胞和树突状细胞)特异性表达的新型宿主限制因子溶酶体跨膜蛋白5(lysosomal-associated transmembrane protein 5,LAPTM5),协助Vpr蛋白帮助病毒逃逸,揭开了存在20余年的''Vpr谜团'', 这一发现也被编辑邀请在Nature旗下的Microbiology Community发表了该研究背后的‘科研轶事’ (链接见文末)。

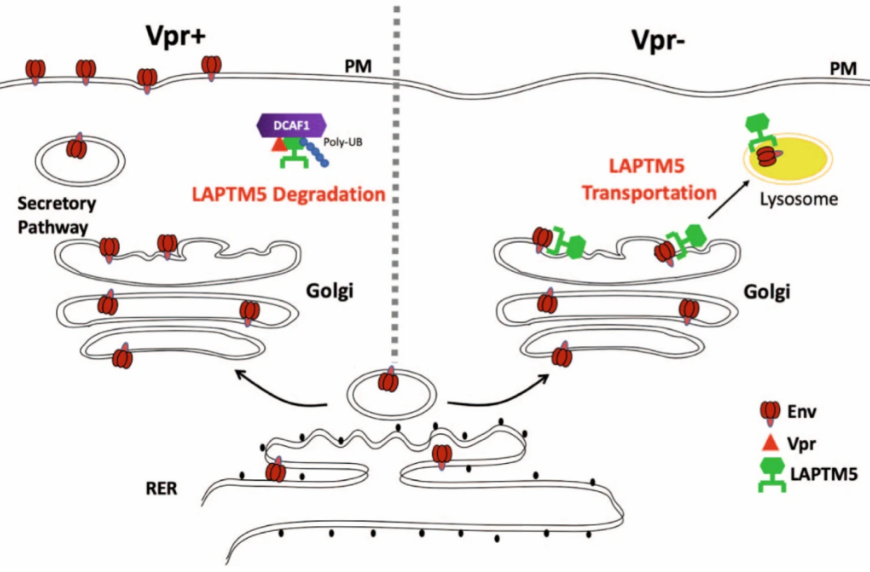
这项最新的研究工作中,为了明确Vpr在HIV-1感染巨噬细胞中的真正作用,该课题组通过对巨噬细胞中可能与Vpr存在相互作用的宿主蛋白进行质谱分析,鉴定出Vpr拮抗的新型宿主限制因子LAPTM5。LAPTM5是一种溶酶体跨膜蛋白,Vpr存在时通过促使LAPTM5泛素化导致其在巨噬细胞内迅速降解,进而瓦解LAPTM5对病毒复制的限制能力。
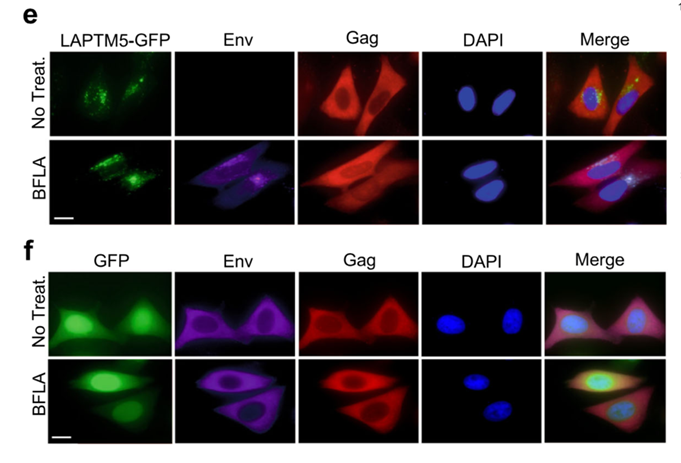
病毒Env蛋白得以从高尔基复合体分泌释放到细胞膜,用于HIV-1子代病毒组装,从而维持了子代病毒颗粒高侵染能力和传播能力。而Vpr不存在时, LAPTM5可以将HIV包膜蛋白Env从高尔基体定向转运到溶酶体降解,从而减少病毒的胞膜蛋白Env的含量。因此,一旦病毒缺少Vpr,虽然还能感染巨噬细胞,但于由子代病毒缺少包膜蛋白Env而不再具有感染力,不能继续感染新的细胞。而在在树突状细胞中,Vpr也以类似的机制对抗LAPTM5帮助病毒逃逸宿主细胞的限制作用。
20年前人们就已经知道Vpr为HIV-1在体内复制所必需,使得HIV-1成为如此致命的病毒且与患者疾病进展密切相关。课题组的这一最新研究成果向我们揭示了病毒如何巧妙的利用Vpr逃逸宿主的免疫限制。更重要的是这一发现的生理意义:目前性传播是人类感染HIV-1的主要途径,而巨噬细胞和树突状细胞在生殖黏膜中大量存在,它们在HIV-1的早期感染中发挥重要作用,同时也是机体对入侵病原体固有免疫和适应性免疫反应之间的重要桥梁,因此,寻找Vpr对抗的巨噬细胞和树突状细胞中的限制性因子并阐明其机制对HIV-1治疗至关重要。LAPTM5的鉴定指出了一种十分有前景的抗逆转录病毒新策略,如靶向Vpr的新型药物可使LAPTM5恢复高效的抗病毒功能,使HIV-1子代病毒颗粒丧失感染能力,为艾滋病治疗策略的发展提供了新的靶点。此外,虽然LAPTM5同源家族的成员LAPTM4A和LAPTM4B在巨噬细胞和树突状细胞表达量不高,也并不参与宿主细胞在生理上对病毒限制能力,但一旦将二者过表达,他们都能有效的抑制HIV病毒复制,说明LAPTM4A和LAPTM4B也是有效的治疗HIV的全新靶点,值得后期深入研究。

原文链接:
https://www.nature.com/articles/s41467-021-24087-8
https://naturemicrobiologycommunity.nature.com/posts/hiv-1-accessory-protein-mystery-mask-vpr。
转载须知
【非原创文章】本文著作权归文章作者所有,欢迎个人转发分享,未经允许禁止转载,作者拥有所有法定权利,违者必究。




 个人中心
个人中心
 我是园区
我是园区




