▲点击上方的蓝色“医谷”关注我们
“置顶公众号”获取最有价值行业趋势信息
医谷微信号:yigoonet
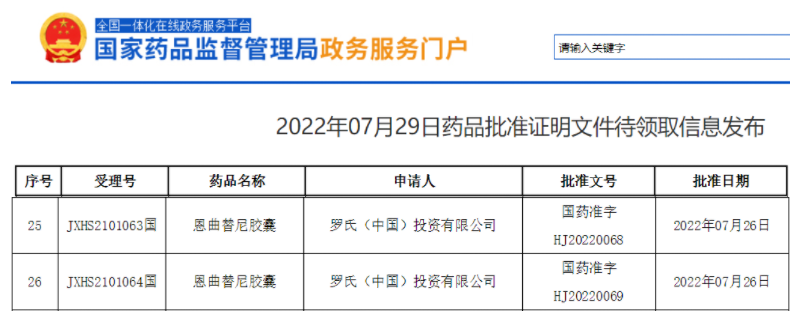
今日(7月29日),罗氏Entrectinib(恩曲替尼)胶囊获中国国家药监局批准上市,适用于经充分验证的检测方法诊断为携带神经营养酪氨酸受体激酶(Neurotrophic tyrosine receptor kinase,NTRK)融合基因且不包括已知获得性耐药突变,患有局部晚期、转移性疾病或手术切除可能导致严重并发症,以及无满意替代治疗或既往治疗失败的成人和12岁及以上儿童实体瘤患者。
神经营养性酪氨酸受体激酶(NTRK)融合阳性癌症发生在NTRK1 / 2/3基因与其他基因融合时,导致TRK蛋白(TRKA / TRKB / TRKC)改变,可激活参与某些类型癌症增殖的信号通路。NTRK基因融合是明确的致癌驱动因素,并在多个瘤种中表达,包括肉瘤、非小细胞肺癌和乳腺癌等,是泛肿瘤的潜在治疗靶点。
恩曲替尼是一款靶向泛TRK及ROS1酪氨酸激酶的具有中枢神经系统(CNS)活性的强效选择性的抑制剂,能够穿过血脑屏障。恩曲替尼最初由美国聚焦肿瘤领域精准治疗药物的Ignyta公司研发,后于2017年12月被罗氏以每股27美元、总价17亿美元收购。自2019年,恩曲替尼陆续在日本、美国、欧盟等地获批上市,用于治疗NTRK融合基因阳性实体瘤患者,以及ROS1阳性晚期非小细胞肺癌患者。
在国内,2020年11月,恩曲替尼在中国获得3项床试验默示许可,拟开发适应症均为用于治疗携带特异性致癌基因改变或潜在的预测性生物标志物的不可切除、局部晚期或转移性实体瘤患者。2021年10月,中国国家药品监督管理局药品审评中心(CDE)受理了恩曲替尼胶囊的上市申请,并将其纳入优先审评。
2022年ELCC大会发布的STARTRK-2 (NCT02568267)研究中恩曲替尼在中国人群中的疗效数据显示,经盲态独立中心审查(BICR)评估,NTRK融合基因阳性患者的全身性ORR达到81%,而颅内ORR高达100%,中位无进展生存期(PFS)高达30.3个月。
值得一提的是,今年4月,拜耳的Larotrectinib(硫酸拉罗替尼胶囊)在国内获批,用于治疗携带NTRK融合基因的实体瘤成人和儿童患者。Larotrectinib与恩曲替尼作用机理类似,也是一款“不限癌种”的疗法,于2018年11月在美国获批上市,是全球首款专为NTRK基因融合癌症患者设计的口服TRK抑制剂。
文 | 医谷
推荐阅读






 个人中心
个人中心
 我是园区
我是园区




