您还不是认证园区!
赶快前去认证园区吧!

药时代路演,点击预约!

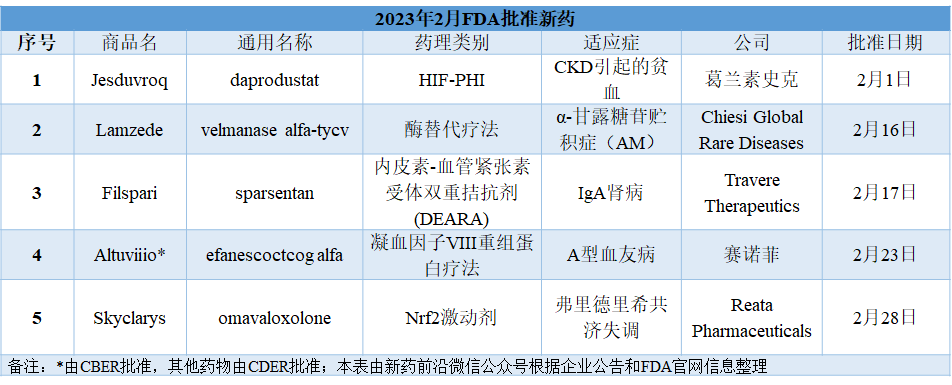
参考资料:
1.孤儿药




FDA拒绝了马斯克脑机接口的人体试验

华人科学家发现有望「治愈」阿尔茨海默病的靶点!临床效果令人震撼......

「灵魂砍价」率先出海,美国胰岛素三巨头被「逼宫」...... Orz
 点击这里,于20w+同药喜相逢!
点击这里,于20w+同药喜相逢!
 药选址
药选址
药时代路演,点击预约!


参考资料:
1.孤儿药




FDA拒绝了马斯克脑机接口的人体试验

华人科学家发现有望「治愈」阿尔茨海默病的靶点!临床效果令人震撼......

「灵魂砍价」率先出海,美国胰岛素三巨头被「逼宫」...... Orz
 点击这里,于20w+同药喜相逢!
点击这里,于20w+同药喜相逢!