又有两张优先审评券(PRV)被出售,总计1.93亿美元
收藏
关键词:
优先审评
资讯来源:医药合作投融资联盟 + 订阅账号
所属行业:化学药制剂 + 订阅行业
发布时间:
2020-11-24
2020年11月23日,致力于改善患有严重自身免疫疾病和癌症患者生活的全球免疫学公司argenx宣布,该公司已同意以9800万美元收购来自Bayer Healthcare Pharmaceuticals,Inc手上的FDA优先审评券(PRV)。PRV可使持有人有权对单个新药申请或生物制品许可申请(BLA)进行FDA优先审查,这可以减少目标审查时间,并有可能导致快速批准。
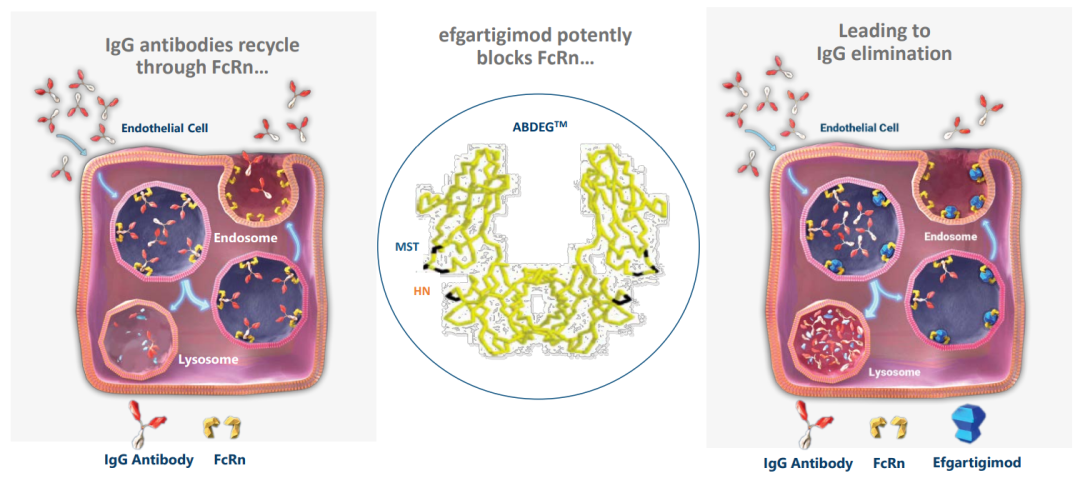
argenx希望将PRV作为其FcRn拮抗剂efgartigimod的未来商业化使用。它不会用于一般性重症肌无力的静脉注射efgartigimod的BLA申请,该申请有望在2020年提交。

argenx首席执行官Tim Van Hauwermeiren说道,“ Efgartigimod有潜力为重度自身免疫性疾病患者提供新的治疗选择。我们目前正在推进静脉内和皮下给药,我们相信这将在给药方案和便利性方面把握患者偏好的差异,并使我们能够达到通过购买PRV,我们将能够寻求对未来营销应用程序的快速审查,并为efgartigimod的开发计划提供更多的可选项。”
Efgartigimod是一种研究性抗体片段,旨在减少引起疾病的免疫球蛋白G(IgG)抗体并阻断IgG回收过程。Efgartigimod与新生儿Fc受体(FcRn)结合,该受体在体内广泛表达,在挽救IgG抗体的降解中起着核心作用。阻断FcRn可以降低IgG抗体水平,这代表了几种已知由致病性IgG抗体驱动的自身免疫疾病的潜在治疗方法,包括:重症肌无力(MG),一种引起肌肉无力的慢性疾病;寻常型天疱疮(PV),一种慢性疾病,特征在于皮肤严重起泡;免疫性血小板减少症(ITP),一种慢性瘀伤和出血性疾病;慢性炎症性脱髓鞘性多发性神经病(CIDP),一种导致运动功能受损的神经系统疾病。
argenx是一家全球免疫学公司,致力于改善患有严重自身免疫疾病和癌症的人们的生活。Argenx通过其免疫学创新计划(IIP)与领先的学术研究人员合作,旨在将免疫学突破转化为世界一流的新型基于抗体的药物组合。Argenx与Janssen合作评估了efgartigimod在多种严重的自身免疫性疾病中的应用,以及cusatuzumab在血液系统癌症中的应用。Argenx还在其治疗专营权中推进几种早期阶段的实验药物。argenx在比利时,美国和日本设有办事处。
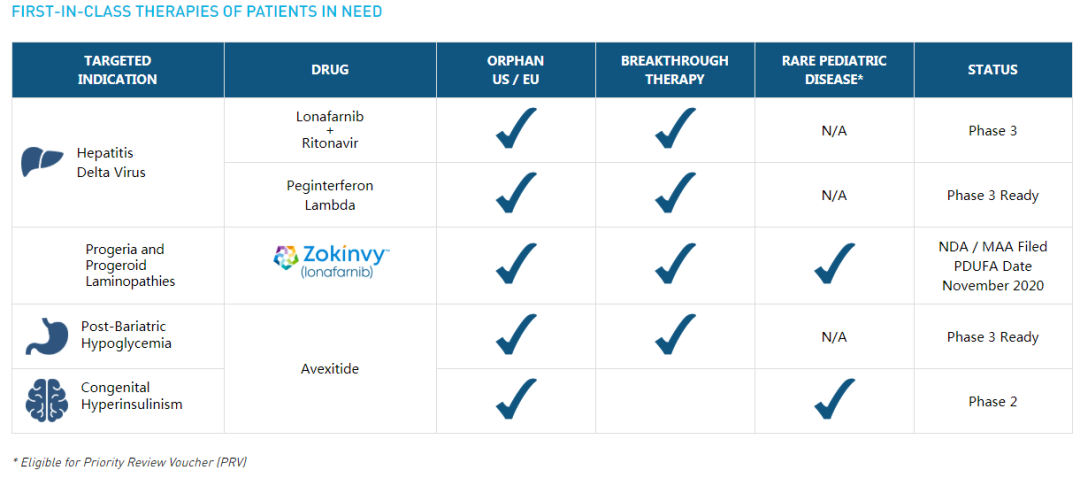
2020年11月23日,加利福尼亚州帕洛阿尔托,Eiger BioPharmaceuticals,Inc.(纳斯达克股票代码:EIGR)专注于针对严重稀有和超稀有疾病的靶向疗法的开发和商业化,宣布达成最终协议,出售其优先审评券(PRV),一次性支付9500万美元。根据与Progeria Research Foundation(PRF)达成的《合作与供应协议》的条款,Eiger将保留收益的50%,即4750万美元。
优先审评券(PRV)是与美国食品和药物管理局 Zokinvy(lonafarnib)最近批准的药物而获得授权,用于治疗早衰症和加工缺陷型早衰症。

Eiger首席执行官兼总裁David Cory说道,“出售优先审评券(PRV)为Eiger提供了重要的非稀释性资金来源,并进一步加强了我们的资产负债表。收益使我们能够继续确保全球所有患有早衰症和加工缺陷型早衰症的儿童和年轻人都能获得诊断到使用Zokinvy,并推进我们的后期开发项目,该项目现在包括三个突破性的治疗资格项目。” “我们很高兴Zokinvy是我们的首个获批产品,也是首个获批的针对患有早衰症和加工缺陷型早衰症的儿童和年轻人的疗法。”
Eiger是一家商业阶段的生物制药公司,致力于针对严重的罕见病和超罕见疾病的高水平医疗需求,开发出一流的,表征良好的药物,并将其商业化。
Zokinvy用于治疗Hutchinson-Gilford早衰综合症(HGPS或Progeria)和加工缺陷型早衰症,是该公司的首个FDA批准。上市许可申请书(MAA)已被接受,并且正在接受欧洲药品管理局(EMA)的审查。Eiger在美国以外的地区建立了全球托管访问计划,该计划预计将覆盖40多个国家/地区,以确保所有患有早衰和早衰症的儿童和年轻人都能获得治疗。
Eiger项目的主要临床计划针对的是人类病毒性肝炎最严重的肝炎三角洲病毒(HDV)感染。Eiger正在开发HDV的两种补充疗法。Lonafarnib是全球第3期临床试验中的一流口服异戊烯化抑制剂。Peginterferon lambda是进入3期临床的一流,耐受性良好的III型干扰素。






 药选址
药选址





