
点评 | 郭列军 (罗格斯大学)、贾伟 (香港浸会大学,上海交通大学附属第六人民医院)
责编 | 兮
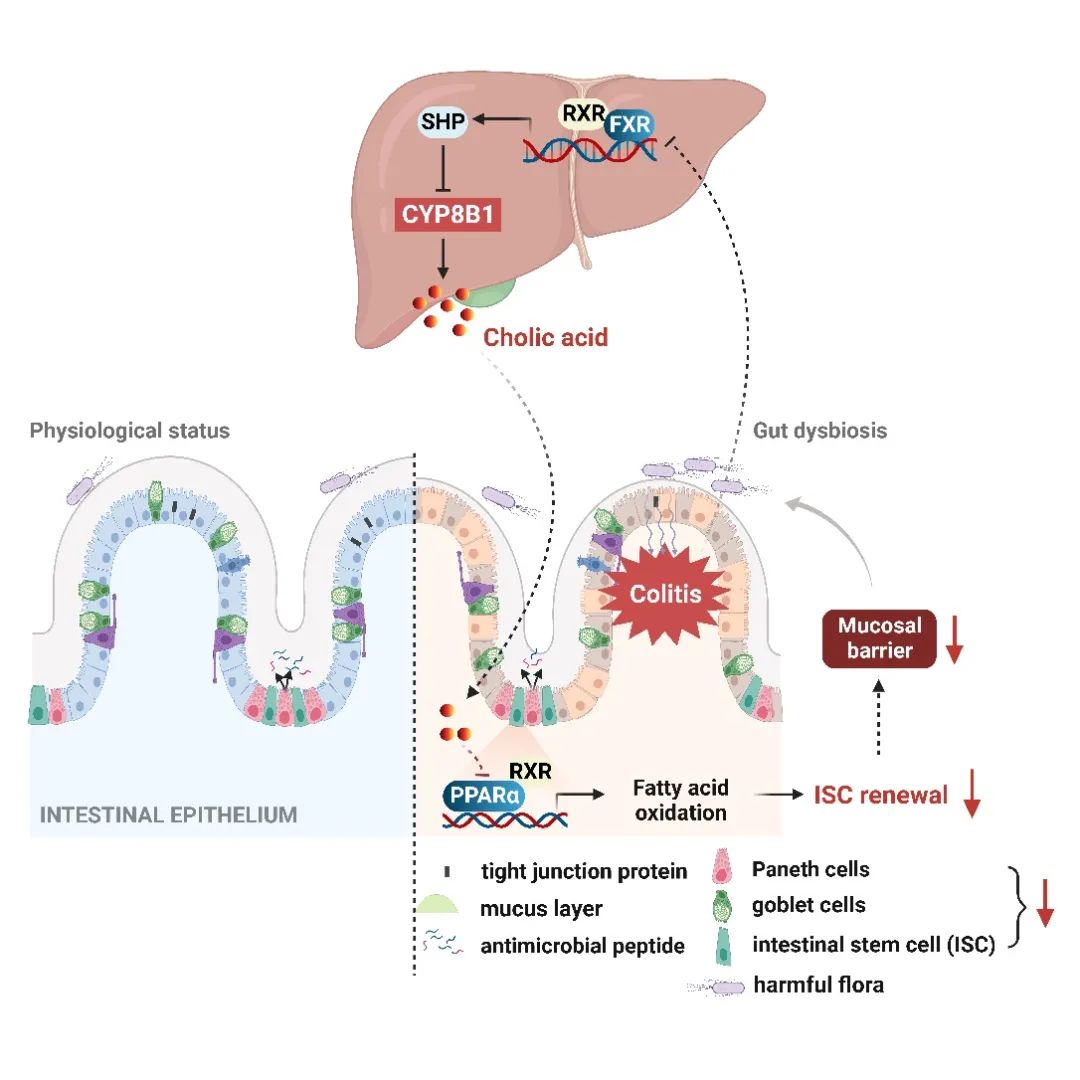
肠道屏障对于内源或外源性有害刺激至关重要,因此,维持肠道屏障稳态及结构完整性将有效防止慢性肠道炎症的发生。目前仍缺乏促进肠上皮屏障再生修复的有效手段,成为影响炎症性肠病(IBD)药物治疗应答的重要因素之一。分布于隐窝结构内的肠干细胞(ISCs)是维持肠道屏障的关键,ISCs一方面维持上皮结构稳态和屏障防御功能,另一方面通过快速更新补充受损的上皮,被认为是调控肠道上皮损伤修复的主要细胞类群【1】。目前,炎症损伤下影响肠道干细胞功能和命运的调控因素(尤其是肠外因素)备受关注,但相关的研究还非常有限。

研究者们发现活动期IBD患者和结肠炎小鼠体内出现胆汁酸代谢紊乱,CA水平显著升高,肝脏CYP8B1活性增加,提示肝脏CYP8B1-CA代谢轴的过度活化与IBD进展存在关联。外源补充CA或在小鼠肝脏中过表达CYP8B1,均可加重IBD病理表型,损伤肠道屏障及ISCs更新能力。相反,CYP8B1缺失则显著缓解肠道损伤和炎症,回复ISCs更新能力。
富含亮氨酸重复序列的G蛋白偶联受体5 (Lgr5)是ISCs的表面标志物,Lgr5+ ISCs主要分布于隐窝基底部,通过稳定的自我更新和分化来维持肠上皮的正常功能。为了深入了解CYP8B1-CA代谢轴如何影响ISCs的更新能力,研究者们分离了结肠炎小鼠的肠道隐窝及Lgr5+ ISCs进行体外培养,发现CA显著抑制Lgr5+ ISCs的增殖,并减弱肠道类器官的出芽和传代能力。有趣地是,研究人员发现CA对ISCs的抑制作用并不依赖于经典胆汁酸受体FXR和TGR5。他们利用RNA-Seq、代谢组学分析及肠特异性敲除小鼠模型,证实了CYP8B1-CA代谢轴通过抑制ISCs中过氧化物酶体活化受体α(PPARα)介导的FAO,阻碍Lgr5+ ISCs的更新功能,进而减缓上皮屏障损伤修复,加重肠炎进展。
最后,研究者们应用FXR激动剂奥贝胆酸(目前尚无CYP8B1特异性抑制剂)抑制CYP8B1表达,发现其可恢复Lgr5+ ISCs活性并有效改善肠炎,进一步证明了肝脏FXR-CYP8B1-CA代谢轴在肠道屏障修复功能中的重要作用。
综上所述,该研究阐明了肝脏胆汁酸代谢酶CYP8B1及其产物CA参与肠道炎症进展的新机制,鉴定了跨器官通讯的代谢信号分子CA,提出了“肠病肝治”新思路。同时,这项研究揭示了FXR激动剂通过调节炎症和促进肠上皮损伤修复从而改善肠道炎症的药理机制,将有助于拓宽FXR激动剂在肠道炎症性疾病中的临床应用。
原文链接:
https://doi.org/10.1016/j.stem.2022.08.008
 郭列军
(Grace L. Guo,罗格斯大学,Rutgers University)
郭列军
(Grace L. Guo,罗格斯大学,Rutgers University)
 贾伟
(香港浸会大学,上海交通大学附属第六人民医院)
贾伟
(香港浸会大学,上海交通大学附属第六人民医院)
制版人:十一
参考文献
1. Thoo, L., Noti, M., and Krebs, P. (2019). Keep calm: the intestinal barrier at the interface of peace and war. Cell death & disease 10, 849. 10.1038/s41419-019-2086-z
2. Annese, V. (2019). A Review of Extraintestinal Manifestations and Complications of Inflammatory Bowel Disease. Saudi J Med Med Sci 7, 66-73. 10.4103/sjmms.sjmms_81_18
3. Mousa, O.Y., Juran, B.D., McCauley, B.M., Vesterhus, M.N., Folseraas, T., Turgeon, C.T., Ali, A.H., Schlicht, E.M., Atkinson, E.J., Hu, C., et al. (2021). Bile Acid Profiles in Primary Sclerosing Cholangitis and Their Ability to Predict Hepatic Decompensation. Hepatology 74, 281-295. 10.1002/hep.31652
4. Sorrentino, G., Perino, A., Yildiz, E., El Alam, G., Bou Sleiman, M., Gioiello, A., Pellicciari, R., and Schoonjans, K. (2020). Bile Acids Signal via TGR5 to Activate Intestinal Stem Cells and Epithelial Regeneration. Gastroenterology 159, 956-968 e958. 10.1053/j.gastro.2020.05.067
5. Jia, W., Wei, M., Rajani, C., and Zheng, X. (2021). Targeting the alternative bile acid synthetic pathway for metabolic diseases. Protein & cell 12, 411-425. 10.1007/s13238-020-00804-9
6. Bertaggia, E., Jensen, K.K., Castro-Perez, J., Xu, Y., Di Paolo, G., Chan, R.B., Wang, L., and Haeusler, R.A. (2017). Cyp8b1 ablation prevents Western diet-induced weight gain and hepatic steatosis because of impaired fat absorption. Am J Physiol Endocrinol Metab 313, E121-E133. 10.1152/ajpendo.00409.2016
7. Kaur, A., Patankar, J.V., de Haan, W., Ruddle, P., Wijesekara, N., Groen, A.K., Verchere, C.B., Singaraja, R.R., and Hayden, M.R. (2015). Loss of Cyp8b1 improves glucose homeostasis by increasing GLP-1. Diabetes 64, 1168-1179. 10.2337/db14-0716
8. Abrigo, J., Gonzalez, F., Aguirre, F., Tacchi, F., Gonzalez, A., Meza, M.P., Simon, F., Cabrera, D., Arrese, M., Karpen, S., et al. (2021). Cholic acid and deoxycholic acid induce skeletal muscle atrophy through a mechanism dependent on TGR5 receptor. Journal of cellular physiology 236, 260-272. 10.1002/jcp.29839
9. Fujino, T., Une, M., Imanaka, T., Inoue, K., and Nishimaki-Mogami, T. (2004). Structure-activity relationship of bile acids and bile acid analogs in regard to FXR activation. Journal of lipid research 45, 132-138. 10.1194/jlr.M300215-JLR200
转载须知
【非原创文章】本文著作权归文章作者所有,欢迎个人转发分享,未经作者的允许禁止转载,作者拥有所有法定权利,违者必究。




 个人中心
个人中心
 我是园区
我是园区






