
PD-1/PD-L1抗体药物彻底改变了癌症治疗格局。后PD-1时代,如何更好的使用PD-1药物,获得最大的临床收益成为重点。
2021年11月,Cancer Cell发表了英国皇家马斯登NHS信托基金会(世界顶级癌症研究中心之一)ADAPTeR前瞻性II期临床研究数据,阐述了anti-PD1抗体药物响应和耐药的决定因素。Determinants of anti-PD-1 response and resistance in clear cell renal cell carcinoma,Cancer Cell 39, 1497–1518, November 8, 2021。
ADAPTeR是由英国皇家马斯登NHS信托基金会在2015年5月注册的临床研究,已经历时6年,期间一直没有相关数据发表。
病人及治疗概况
2015年10月至2018年6月纳入15例患者,根据国际转移性RCC数据库联盟((IMDC)风险分类(STAR方法)的定义,13例(87%)患者患有中度或不良预后风险疾病。在临床数据锁定时(2018年12月),中位随访时间为12.5个月(范围为3.9至27.3个月)。有6人死亡,均因疾病进展所致。中位无进展(PFS)和总生存期(OS)分别为4.1个月和22.2个月。
临床获益的患者(以下简称“应答者”)定义为有部分反应(PR)或疾病稳定(SD)的患者。临床获益最小的患者(以下称为“无反应者”)在入组后6个月内疾病进展的患者。
研究路线图
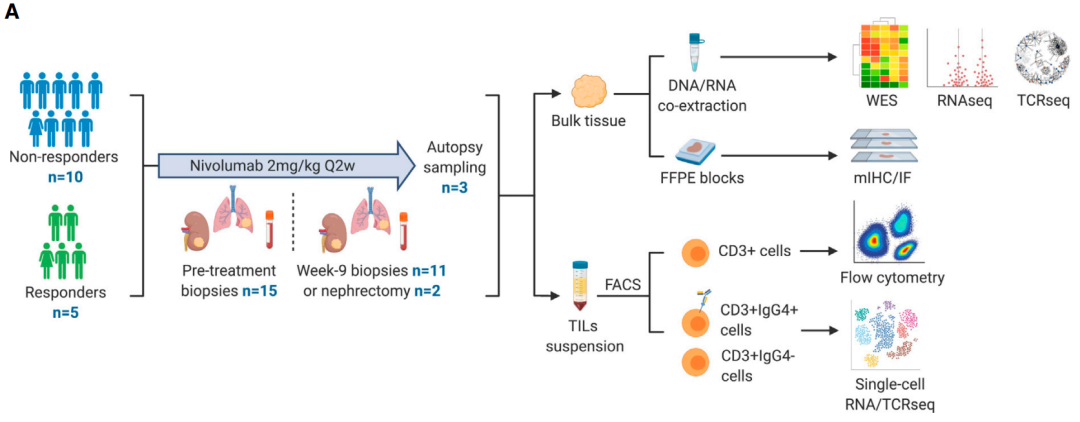
15例患者治疗前组织活检取样,nivolumab治疗后,第9周活检或手术时(如果进行)和疾病进展时接受了原发性和/或转移部位的多区域肿瘤取样。
ADAPTeR的一个关键目的是在整个治疗过程中评估分子和肿瘤免疫微环境(TME)的特征。此外,患者被共同招募到TRACERx Renal (TRAcking Cancer Evolution through therapy[Rx]; NCT03226886)研究, 和 PEACE (Posthumous Evaluation of Advanced Cancer Environment;
NCT03004755)研究,以扩大分析的时空广度。综合分析nivolumab应答、全外显子和RNA测序(RNA-seq)、TCR测序和免疫组化/多重免疫荧光(IHC/mIF)数据;并进行高维流式细胞术分析。
研究结果总结
分析来自于15个病人,治疗前和治疗后总计115份肿瘤样本。
T细胞表型
治疗之前,CD8+T细胞的TCR有高度一致性的患者(即肿瘤特异性T细胞为主),在治疗后检测时,这些CD8+T细胞克隆可以维持,且具有高细胞毒性表型(GZMB/K表达),可以杀伤肿瘤细胞,对于PD-1治疗产生良好应答。
若治疗前检测,CD8+T细胞的TCR呈现高度的多样性(即没有明显的肿瘤特异性T细胞群体),在治疗后检测时,CD8+T细胞依旧呈现多样性TCR,且其缺乏细胞毒性表型(GZMB/K表达),无法有效杀伤肿瘤细胞,对PD-1治疗无明显应答,肿瘤进展。

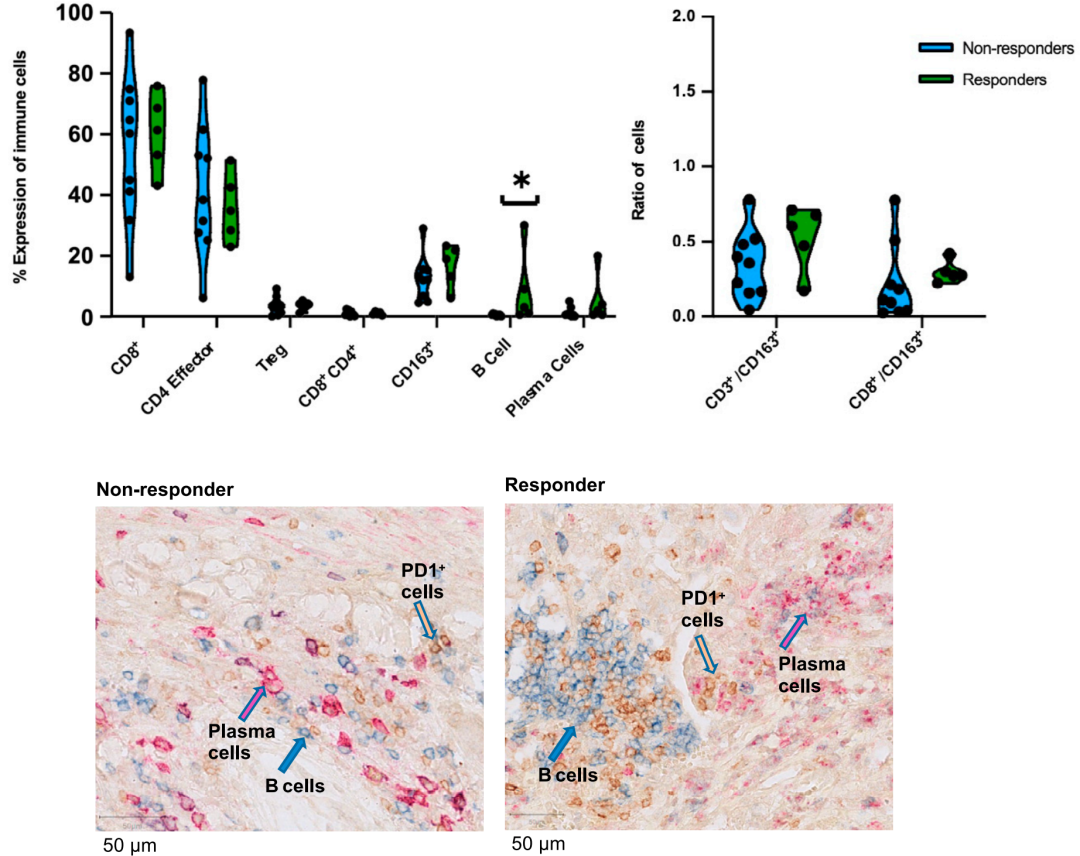
B细胞及三级淋巴结构
与生物制药小编之前文章《颠覆!B细胞才是免疫检查点抗体最佳预测标志物,而非T细胞》报道一致,治疗前样本中,B细胞数量在应答患者和非应答患者间有最好的区分度。免疫组化染色,可以清晰的看出,应答患者有结构完整的三级淋巴结构的形成,在这里B细胞等可以更好的激活细胞毒性T细胞,使其产生细胞毒性表型。
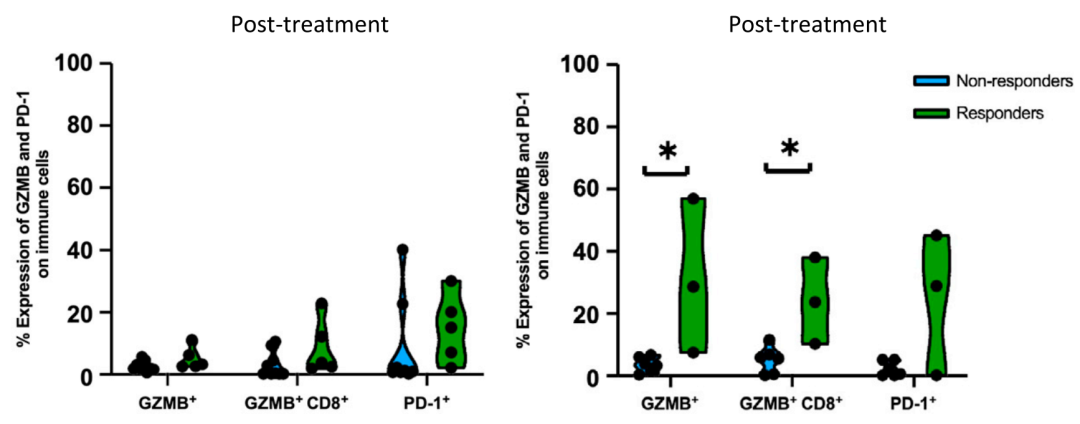
颗粒酶B
治疗之后进行分析,有应答的患者,其CD8+T细胞细胞毒性标志物颗粒酶B(GZMB)明显上调,而无应答患者没明显变化。
小编小结
国皇家马斯登NHS信托基金会进行的ADAPTeR研究,虽然病例数量少,但还是提供了一些非常有意义的数据。如治疗前,B细胞的数量依旧是区分度最好的预测标志物,这与之前Nature背靠背的研究数据一致。治疗后,应答患者的CD8+T细胞的细胞毒性标志物颗粒酶B(GZMB)表达明显上调,提示其杀伤活性增强。作者另外一个发现是,应答患者的CD8+T细胞克隆是治疗前就存在的,一直维持到治疗之后,无应答患者的CD8+T细胞克隆无法很好的维持,因而作者认为,患者本身存在肿瘤抗原特异性的CD8+T细胞克隆,且能被有效活化,在PD-1治疗过程中,能够表现出细胞毒性表型,产生良好的临床应答。这些临床数据,为更多免疫检查点抑制剂的临床研究,以及后PD-1时代,合理有效的临床用药提供了数据参考及伴随诊断的思路。
主要参考文献
1.McDermott, D.F., Lee, J.L., Ziobro, M., Suarez, C., Langiewicz, P., Matveev, V.B., Wiechno, P., Gafanov, R.A., Tomczak, P., Pouliot, F., and Donskov, F. (2021). Open-label, single-arm, phase II study of pembrolizumab monotherapy as first-line therapy in patients with advanced non-clear cell renal cell carcinoma. J. Clin. Oncol. 39, 1029–1039.
2.Barennes, P., Quiniou, V., Shugay, M., Egorov, E.S., Davydov, A.N.,Chudakov, D.M., Uddin, I., Ismail, M., Oakes, T., Chain, B., and Eugster, A. (2020). Benchmarking of T cell receptor repertoire profiling methods reveals large systematic biases. Nat. Biotechnol. 39, 236–245.
3.Determinants of anti-PD-1 response and resistance in clear cell renal cell carcinoma,Cancer Cell 39, 1497–1518, November 8, 2021。
4.Bi, K., He, M.X., Bakouny, Z., Kanodia, A., Napolitano, S., Wu, J., Grimaldi, G., Braun, D.A., Cuoco, M.S., Mayorga, A., et al. (2021). Tumor and immune reprogramming during immunotherapy in advanced renal cell carcinoma. Cancer Cell 39, 649–661.




 个人中心
个人中心
 我是园区
我是园区




