「 本文共:15条资讯,阅读时长约:3分钟 」






1.首款弗里德赖希共济失调症新药获批。Reata公司Nrf2激动剂Skyclarys获FDA批准上市,用于治疗16岁以上弗里德赖希共济失调症(FA)患者。这是FDA批准针对FA的首款药物。Skyclarys(Omaveloxolone)靶向Nrf2转录因子并诱导多个分子通路以恢复线粒体功能、降低氧化应激、抑制促炎信号,以减轻炎症反应。此前,FDA已授予omaveloxolone孤儿药资格、快速通道资格以及罕见儿科疾病认定。
2.O药辅助治疗黑色素瘤报sBLA。百时美施贵宝PD-1抑制剂纳武利尤单抗(Opdivo)补充生物制剂许可申请(sBLA)获FDA受理,用于单药辅助治疗IIB或IIC期黑色素瘤患者,PDUFA日期为2023年10月13日。在Ⅲ期临床(CheckMate-76K)中,Opdivo较安慰剂降低患者58%的复发或死亡风险(HR:0.42,95% CI:0.30-0.59,p<0.0001)。在欧洲,Opdivo的该适应症上市申请正接受EMA的集中审查。
3.FIC单抗HAE关键Ⅲ期临床积极。CSL公司新型FXIIa抑制性garadacimab预防性治疗遗传性血管水肿(HAE)患者的关键Ⅲ期临床最新结果积极。与安慰剂相比,每月一次皮下注射garadacimab可显著降低HAE的发作频率,平均发作率降低86.5%,中位发作率降低100%,调整基线发作率后的平均发作率降低89.2%;该组6个月期间无发作的患者比例达到61.5%,有74.4%使用garadacimab的患者发作减少≥90%。药物总体耐受性良好。
4.马赛替尼AD关键Ⅲ期临床积极。AB Science公司在国际期刊Alzheimer's Research & Therapy上公布多激酶抑制剂马赛替尼(masitinib)治疗轻中度阿尔茨海默病(AD)患者的关键Ⅲ期试验积极结果。与安慰剂相比,masitinib治疗组患者ADAS-cog评分(认知评估量表)较基线显著改善;两组ADAS-cog评分变化分别为-1.46和+0.69,差异为-2.15(p=0.0003),具统计学意义。药物安全性特征与已知研究一致。
5.FIC干眼症小分子药物最新临床积极。Aldeyra公司潜在“first-in-class”小分子活性醛化物质抑制剂Reproxalap用于干眼症治疗的临床试验达到主要终点。12个月治疗期间,未观察到与治疗相关的严重不良事件;治疗组与对照组相比,眼部安全性参数相似;reproxalap治疗组患者视力评估指标logMAR改善约37%(P<0.0001),优于对照组(P=0.018)患者。FDA已于2月初受理它的新药申请,预计11月23日前完成审评。
6.Vertex联手Tevard开发创新tRNA疗法。Vertex公司与Tevard Biosciences将利用后者专有的tRNA药物发现平台,合作开发创新tRNA疗法,用以治疗因无义突变所导致的杜氏肌营养不良症(DMD)。Tevard开发的tRNA疗法能够作用于位于基因任何位点的突变,而且不会改变细胞内的调节元件或引入外源遗传调节元件,更具安全性。根据协议,Tevard将获得预付款、里程碑款项;Vertex将负责产品的临床开发、生产与商业化。


1.国内首部儿童中药真实世界研究指南发布。2月26日,由中国人口福利基金会支持,天津中医药大学第一附属医院承担编写的《儿科常见病中药真实世界研究设计指南》定稿暨验收会顺利召开。这是国内首部儿童中药RWS设计指南,充分体现儿童中药RWS与成人研究的区别之处,符合中医药学特点以及评价方法体系。该设计指南遵循国家药品监督管理局药品审评中心(CDE)近期发布的RWS相关指导原则,将RWS方法引入到儿童中药研发策略之中,并推荐了相应的研发路径,强调了采用RWS的方法形成人用经验证据的可行性、便捷性与适宜性。
2.北京新增一家三级中医医院。2月27日,北京市密云区中医医院顺利通过三级中医医院现场评审验收,正式被北京市中医管理局批准为“三级中医医院”。未来,北京市密云区中医医院将以与北京中医药大学第三附属医院共建中西医旗舰医院为目标,进一步加强中医人才培养和储备、中医特色专科建设等,逐步实现与总院区的同质化管理;并力争三年设置期满后,创建三级甲等中医医院。
3.99%的统筹地区门诊看病可报销。国家医保局日前透露,全国目前已有99%的统筹地区开展了普通门诊统筹,更多定点零售药店纳入门诊报销范围。2023年以来,全国定点医疗机构已实现普通门诊统筹结算4.41亿人次,日均结算超过780万人次,完成结算金额462.4亿元;全国已有2962万人次在定点零售药店实现结算,结算金额14.34亿元,职工参保人在药店次均报销48.41元。


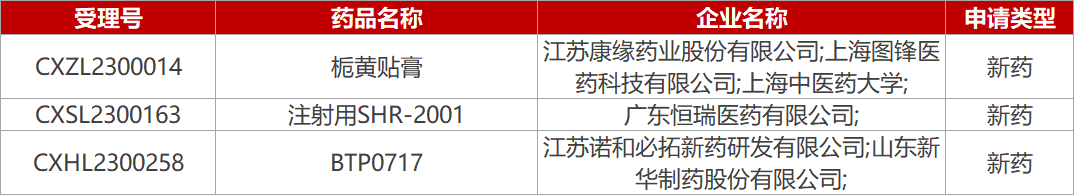
1. CDE新药受理情况(03月01日)


上个交易日 A 股医药板块 +0.05%
涨幅前三 跌幅前三
英 诺 特 +7.50% 兴齐眼药 -8.56%
九 芝 堂 +6.38% 峆一药业 -8.12%
*ST 辅仁+5.22% 安图生物 -7.09%
- The End -





 个人中心
个人中心
 我是园区
我是园区




