
LBCL是来源于成熟B细胞的一种恶性淋巴瘤,其中的弥漫性大B细胞淋巴瘤(DLBCL)是最常见的非霍奇金淋巴瘤(NHL)类型,约占所有NHL的25%~50% [2]。经过一线治疗,仍可能有30%~40% DLBCL患者复发或难治[3],而一旦进展为复发或难治,中位生存期可能仅有6.3个月[4]。CAR-T细胞治疗的问世,变革了LBCL传统治疗模式。奕凯达®是我国首款获批的用于治疗r/r LBCL的CAR-T细胞治疗产品,显著提高了缓解率和长期生存,引领淋巴瘤治愈新时代的到来。
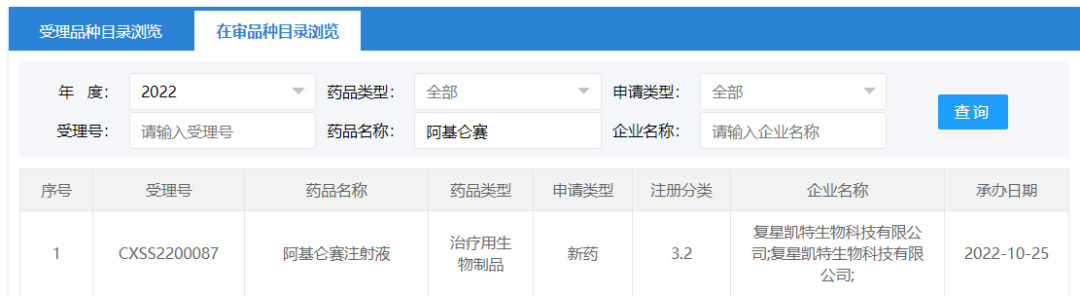
奕凯达®(阿基仑赛注射液)是复星凯特从美国Kite引进Yescarta®技术,并获授权在中国进行本地化生产的自体靶向CD19 CAR-T细胞治疗药品。2021年6月23日,奕凯达®正式获得NMPA批准上市,用于治疗既往接受二线或以上系统性治疗后r/r LBCL成人患者,包括DLBCL非特指型(NOS),原发纵隔大 B细胞淋巴瘤(PMBCL)、高级别 B 细胞淋巴瘤和滤泡性淋巴瘤转化的 DLBCL[5]。2022年4月和10月,美国FDA和欧盟委员会(EC)均依据ZUMA-7研究结果,相继批准了Yescarta®新适应症的上市注册申请,即用于一线免疫化疗无效或在一线免疫化疗后12个月内复发的LBCL成人患者的治疗[6,7]。中国紧随其后,2022年10月14日,CDE公示奕凯达®新适应症上市注册申请拟被纳入优先审评[8]。10月25日最新消息显示,该新适应症上市注册申请正式进入审理阶段[1]。本次新适应症上市注册申请参照《生物制品注册分类及申报资料要求》中的3.2类新药分类(境外已上市、境内未上市的生物制品申报在境内生产上市),进行注册申报[9]。
此次奕凯达®申报的新适应症将已获批的LBCL三线治疗前移至二线,为中国LBCL患者提供了新的治疗选择。衷心期待奕凯达®新增适应症早日获批,惠及更多中国LBCL患者!
免责声明:本资料为专业医学资料,旨在促进医药信息的沟通和交流,仅供医疗卫生专业人士参考;任何处方请参考产品最新详细处方资料。




 个人中心
个人中心
 我是园区
我是园区




