您还不是认证园区!
赶快前去认证园区吧!
▎药明康德内容团队编辑
剑指晚期肾细胞癌!创新免疫组合疗法递交监管申请

有望明年2月获批!DMD创新疗法斩获FDA优先审评资格
Sarepta Therapeutics公司宣布,美国FDA已经接受该公司寻求加速批准casimersen(SRP-4045)的新药申请(NDA),并授予其优先审评资格,预计将在2021年2月25日之前做出回复。FDA同时表示,目前不打算成立咨询委员会来讨论该申请。Casimersen是一种磷酸二酰胺吗啉寡聚物(PMO),用于治疗特定杜氏肌营养不良(DMD)患者。他们携带的基因突变适于使用外显子45跳跃的策略进行治疗。大约有8%的DMD患者适用于这种治疗策略。
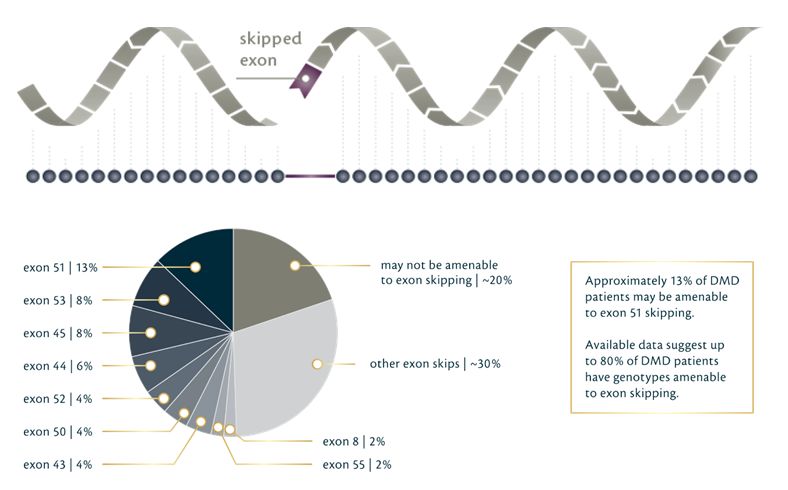
▲通过外显子跳跃可以治疗大部分DMD患者(图片来源:Sarepta官网)
迎击特定非小细胞肺癌!德国默克MET抑制剂获FDA优先审评资格
德国默克(Merck KGaA)旗下EMD Serono宣布,美国FDA已接受口服MET抑制剂tepotinib的新药申请(NDA),并授予其优先审评资格。适应症为治疗存在MET外显子14(METex14)跳跃突变的转移性非小细胞肺癌(NSCLC)成人患者。这一申请目前正在FDA的实时肿瘤学审评(RTOR)试点项目下接受审评,该项目旨在创建更高效的审评程序,尽早为患者带来安全有效的疗法。
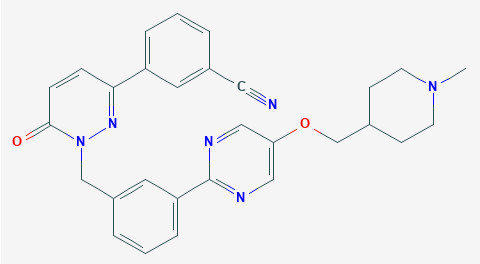
▲Tepotinib分子结构式(图片来源:PubChem)
该申请是基于关键性2期临床试验VISION的结果。试验结果表明,包括脑转移患者和通过液体活检(LBx)和组织活检(TBx)评估的患者在内,不同治疗线的缓解率和持久抗肿瘤活性一致。来自VISION研究初步分析的数据于2020年5月29日发表在《新英格兰医学杂志》(NEJM)上,并在美国临床肿瘤学会(ASCO)ASCO20虚拟科学计划中公布。经独立评审委员会(IRC)评估的患者总缓解率(ORR)为46%,患者的中位缓解持续时间(DOR)为11.1个月。
全球首批!创新疗法提高肾脏移植成功率
致力于开发治疗IgG介导罕见疾病创新疗法的Hansa Biopharma公司宣布,欧盟委员会已有条件批准其IgG裂解酶Idefirix(imlifidase)上市,用于治疗高致敏肾移植患者。
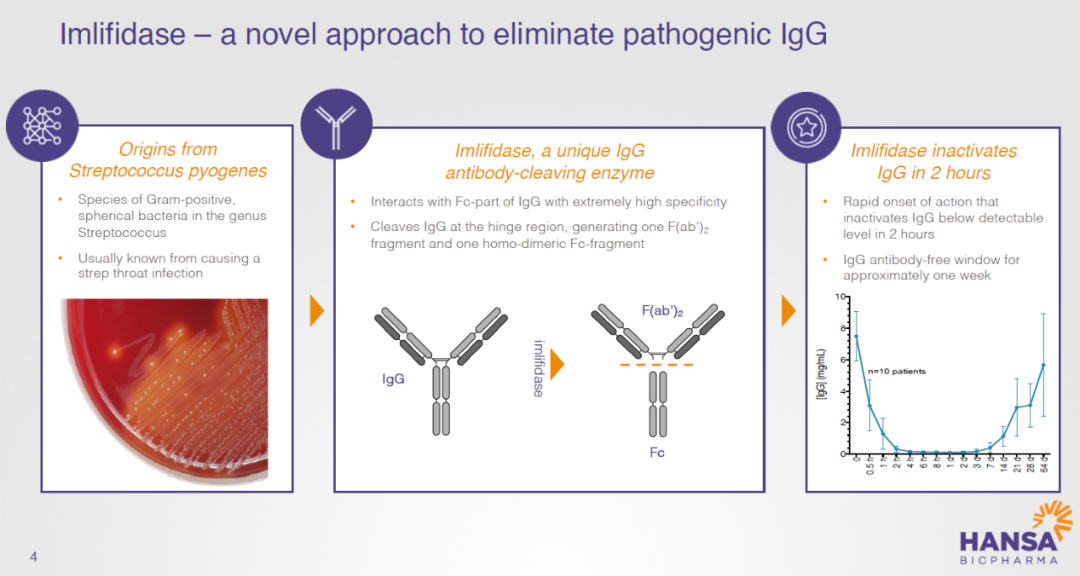
图片来源:Hansa公司官网
治疗困扰85%青少年的皮肤疾病!FDA批准40年来首款新机制疗法!
Cassiopea公司宣布,美国FDA批准Winlevi(clascoterone,1%乳剂)上市,用于治疗12岁及以上患者的痤疮(acne)。痤疮又被称为粉刺或者青春痘,影响到全球超过6.4亿人的生活,尤其在12-25岁的青少年群体中,85%受到它的困扰。新闻稿指出,这款创新疗法是40年来FDA批准的首款具有创新作用机制的痤疮药物。值得一提的是,这款创新药物的作用机制让它还具备治疗雄激素性脱发的潜力,可能成为众多“谢顶”人士的福音。

助力个体化疗法选择!又一款泛肿瘤液体活检获FDA批准
罗氏(Roche)旗下Foundation Medicine宣布美国FDA批准了其泛肿瘤液体活检产品FoundationOne Liquid CDx。该产品是一种基于新一代测序(NGS)技术的定性体外诊断(IVD)测试,利用晚期癌症患者的外周全血中分离的循环游离DNA(cfDNA)分析324个基因,可报告311个基因的短变异,包括BRCA1/2的重排和拷贝数丢失。
作为伴随诊断,确定哪些患者可能从FDA批准的特定靶向疗法中获益,包括为PARP抑制剂Rubraca(rucaparib)筛选携带BRCA1/2基因突变的转移性去势抵抗性前列腺癌患者,以及三种一线治疗非小细胞肺癌的酪氨酸激酶抑制剂(TKI)的患者选择;
为开发精准治疗药物的生物医药公司加速伴随诊断开发;
以及作为一款全基因组图谱分析(CGP),报告基因组改变结果(包括血液肿瘤突变负荷TMB和高微卫星不稳定性,以及单基因变异),为患有任何实体瘤患者的护理提供指导。

图片来源:Foundation Medicine官网
版权说明:本文来自药明康德内容团队,欢迎个人转发至朋友圈,谢绝媒体或机构未经授权以任何形式转载至其他平台。转载授权请在「药明康德」微信公众号回复“转载”,获取转载须知。




 个人中心
个人中心
 我是园区
我是园区




