
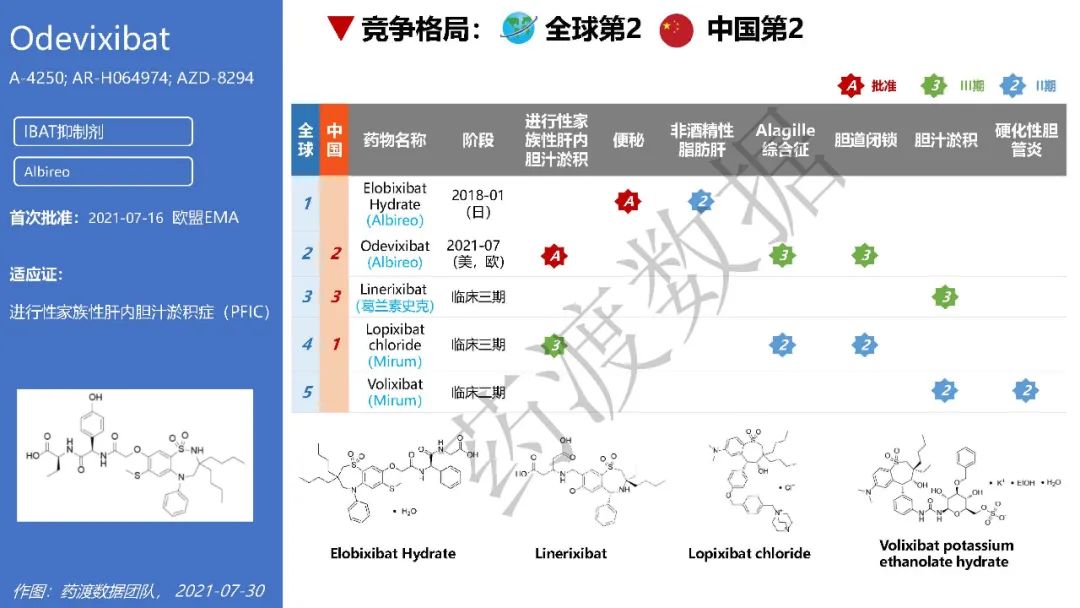
Odevixibat(Bylvay®)由孤儿药公司Albireo研发,是一种回肠胆汁酸转运体(IBAT)抑制剂,于2021年7月16日和20日分别获得欧洲药品管理局(EMA)和美国食品药品监督管理局(FDA)批准上市,该药是第一个被批准用于治疗所有亚型的进行性家族性肝内胆汁淤积症药物
[1]
。
进行性家族性肝内胆汁淤积症是一种常染色体隐性遗传病,常发病于新生儿或1岁以内婴幼儿,发病率约为1:100000至1:50000,男女发病率无差异。该病的病因为不同基因类型突变导致胆汁酸转运缺陷,进而引起胆汁淤积和肝细胞损伤,通常出现渐进性黄疸、严重的瘙痒症,可反复发作或持续进展,最终会导致肝纤维化、肝硬化乃至肝衰竭
[2]
。
Odevixibat的获批基于一项为期24周的随机双盲安慰剂对照试验(PEDFIC1:NCT03566238,A4250-005),试验共招募了62名年龄在6月龄至17岁之间的PFIC1型或2型儿科患者。患者随机分为安慰剂组(n=20)、Odevixibat标准剂量组(40mcg/kg)(n=23)和高剂量组(120mcg/kg)(n=19),每日给药一次,早晨随餐服用。24周治疗期后,Odevixibat的治疗患者血清胆汁酸水平降低70%或达到≤70μmol/L患者的比例远大于安慰剂组(标准剂量组:44%;高剂量组:21%;安慰剂组:0%),并且Odevixibat治疗的患者瘙痒情况也得到明显改善
[3,4]
。
Odevixibat详情及IBAT抑制剂化学药的竞争格局,见下图:
(点击可放大)
https://data.pharmacodia.com/v3/insight/#/ListPdf?tag=2
参考资料
1.药渡数据 https://data.pharmacodia.com
2.李雪松,舒赛男,黄志华.进行性家族性肝内胆汁淤积症诊治进展.中国实用儿科杂志.2020 Apr. 35(4): 319-323.
3.FDAlable:https://www.accessdata.fda.gov/drugsatfda_docs/label/2021/215498s000lbl.pdf
4.EMAEPAR:https://www.ema.europa.eu/en/documents/assessment-report/bylvay-epar-public-assessment-report_en.pdf
声明:药渡数据出品,未经允许禁止转载









 个人中心
个人中心
 我是园区
我是园区




