Neuron | 张晓昌团队揭示靶向剪接提高SYNGAP1在神经元中的表达量
收藏
关键词:
揭示神经Neuron靶向
资讯来源:BioArt + 订阅账号
发布时间:
2023-03-31

神经元之间通过突触相互连接和交流,处理复杂的内外源信息,并且不断调整连接的强度,从而形成学习、记忆和意识的生物学基础。人类遗传学研究表明,突触蛋白编码基因的致病突变是多种神经系统发育障碍的遗传学病因。其中SYNGAP1基因突变是导致癫痫、智力障碍和自闭症谱系障碍等神经发育疾病最突出的病因之一。SYNGAP1基因编码突触Ras GTP酶激活蛋白1
(Synaptic Ras GTPase Activating Protein 1)
。该蛋白广泛存在于兴奋性神经元的突触后膜,参与突触连接长时程增强
(long-term potentiation, LTP)
的形成,对学习和记忆具有重要作用。
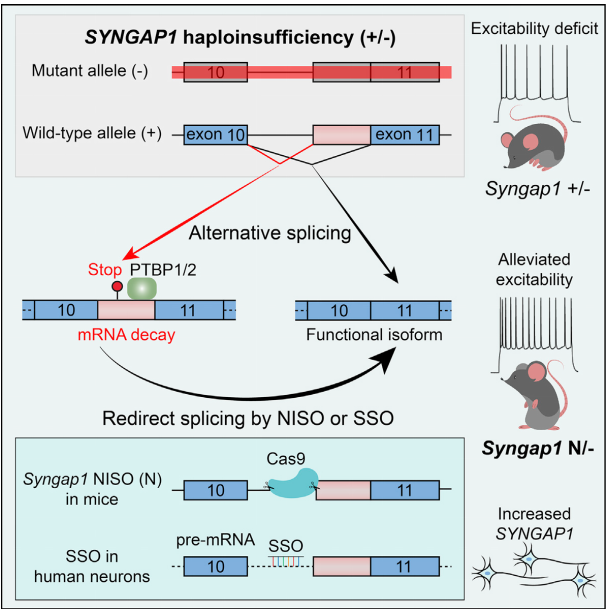
正常神经元具有两个SYNGAP1等位基因;如果其中一个等位基因发生突变而失去功能,另一个等位基因编码的SYNGAP1蛋白量不足以维持正常的神经功能——这种现象称为半倍剂量不足
(haploinsufficiency)
。SYNGAP1致病突变有两个特点: (1) 导致功能缺失
(loss-of-function, LoF)
, (2) 显性突变,即单个等位基因突变即可致病。目前人们对SYNGAP1在神经系统发育过程中表达量的调控机制尚不清楚,也暂无针对SYNGAP1突变的有效治疗方法。既然SYNGAP1突变的致病机理是半倍剂量不足,那么能否提高非突变等位基因的表达量,从而改善SYNGAP1整体功能?
2023年3月13日,芝加哥大学人类遗传学系和神经科学研究所张晓昌教授团队在Neuron杂志发表研究论文
Upregulation of SYNGAP1 expression in mice and human neurons by redirecting alternative splicing
。在这篇论文中,作者对SYNGAP1可变剪接的功能和分子机制进行深入研究,
发现SYNGAP1 10号内含子在神经干细胞和神经元中具有显著不同的剪接模式,可用于调节SYNGAP1的表达量。
作者综合运用小鼠模型、干细胞模型和脑类器官模型,证明10号内含子可能是极具潜力的治疗靶点。
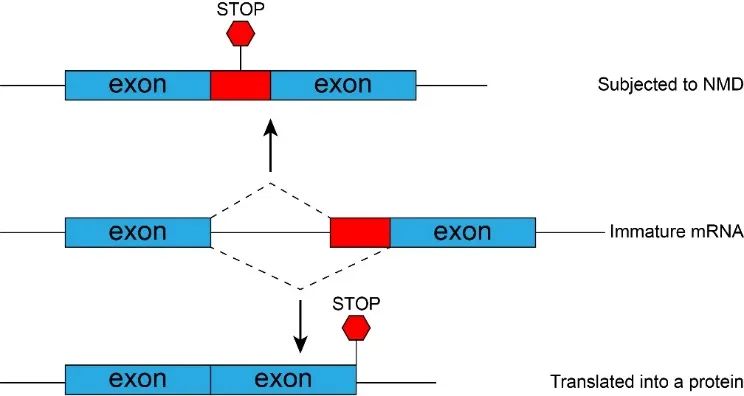
在神经干细胞分化至成熟神经元的过程中,可变剪接可以通过诱导mRNA降解而调节基因表达的平衡状态。如图1所示,排在中间的是一条未成熟的mRNA,它有两种剪接形式:跳过或者包含中间的外显子
(红色标注)
。跳过这个外显子可以产生一条功能性的mRNA,进而翻译出对应的蛋白质。然而,包含这个外显子则会引入提前的终止密码子,导致mRNA被降解,无法从中翻译出蛋白质——这种机制称为“无义介导的mRNA降解
(nonsense-mediated mRNA decay, NMD)
”
(图1)
。
作者对神经干细胞和神经元之间的差异剪接事件进行分析,发现SYNGAP1的10号内含子存在可变剪接位点。该可变剪接在小鼠神经发育早期和非神经组织中富集,但是随着神经系统发育成熟而逐渐降低。通过一系列实验,作者发现可变剪接导致mRNA降解。使用CRISPR技术敲除该可变剪接位点后,小鼠脑组织中的Syngap1蛋白表达水平升高,Syngap1半倍剂量不足小鼠模型的神经功能缺陷得到显著改善。令人惊喜的是,剪接转换寡核苷酸
(splice-switching oligonucleotide, SSO)
在SYNGAP1突变病人来源的iPSCs中能够降低mRNA降解并提高功能性mRNA。进一步,作者展示SSO能够提高脑类器官的SYNGAP1蛋白表达量。
综上所述,文章显示
SYNGAP1 10号内含子的可变剪接可用于调控SYNGAP1表达,有作为治疗靶点的可行性和潜力。
文章第一作者是杨润威博士和冯欣然博士, 其他合作者包括芝加哥大学的Alfredo Garcia, Christian Hansel, Marcelo Nobrega教授。
https://www.cell.com/neuron/pdf/S0896-6273(23)00125-3.pdf
制版人:十一

【非原创文章】本文著作权归文章作者所有,欢迎个人转发分享,未经作者的允许禁止转载,作者拥有所有法定权利,违者必究。









 药选址
药选址







