食管癌进程的车轮2 | 天津医科大学张锴组运用修饰多组学全面揭示琥珀酰化调控细胞迁移机制
收藏
关键词:
揭示细胞癌
资讯来源:精准医学与蛋白组学 + 订阅账号
所属行业:化学药制剂 + 订阅行业
发布时间:
2020-11-02
景杰学术 | 报道
题目:
Systematic Proteome and Lysine Succinylome Analysis Reveals the Enhanced Cell Migration by Hyposuccinylation in Esophageal Squamous Cell Cancer (系统蛋白质组学和琥珀酰化修饰组学揭示低琥珀酰化加速食管鳞癌细胞迁移机制)
期刊:
Molecular & Cellular Proteomics
主要结论:
低赖氨酸琥珀酰化作用可通过负调节组蛋白甲基化,促进ESCC细胞在体内的生长、迁移和侵袭。
关键词:
食管鳞状细胞,翻译后修饰,琥珀酰化,细胞迁移
食管鳞状细胞癌
(ESCC)
是食道癌的主要亚型
(超过90%)
,具有很高的侵袭性,五年生存率仅为10%。最近的大规模基因组图谱分析确定了许多与ESCC相关的突变基因和关键途径
[1, 2]
,但还未建立有效的靶向疗法。目前大多数药物的靶标都是蛋白质,然而是怎样的蛋白质及其翻译后修饰
(PTM)
变化导致了ESCC发病,目前尚不清楚。所以挖掘蛋白质及其翻译后修饰的病理性改变,可能有助于药物的开发。
近日,来自天津医科大学
张锴
教授课题组、汕头大学李恩民教授和许丽艳研究员团队在蛋白质组学领域top期刊Mol Cell Proteomics发表重要研究成果。研究者对SHEE
(良性)
及SHEEC
(恶性)
细胞
(样本策略)
使用蛋白质组学、磷酸化修饰组学、乙酰化修饰组学和琥珀酰化修饰组学
(质谱策略)
进行了全面的定量表征
,揭示了低赖氨酸琥珀酰化作用可通过负调节组蛋白甲基化,促进ESCC细胞在体内的生长、迁移和侵袭。本项工作证实了低蛋白质琥珀酰化修饰是调节ESCC细胞代谢和迁移的关键PTM。
景杰生物
为该研究中的乙酰化修饰组学和琥珀酰化修饰组学提供技术支持。
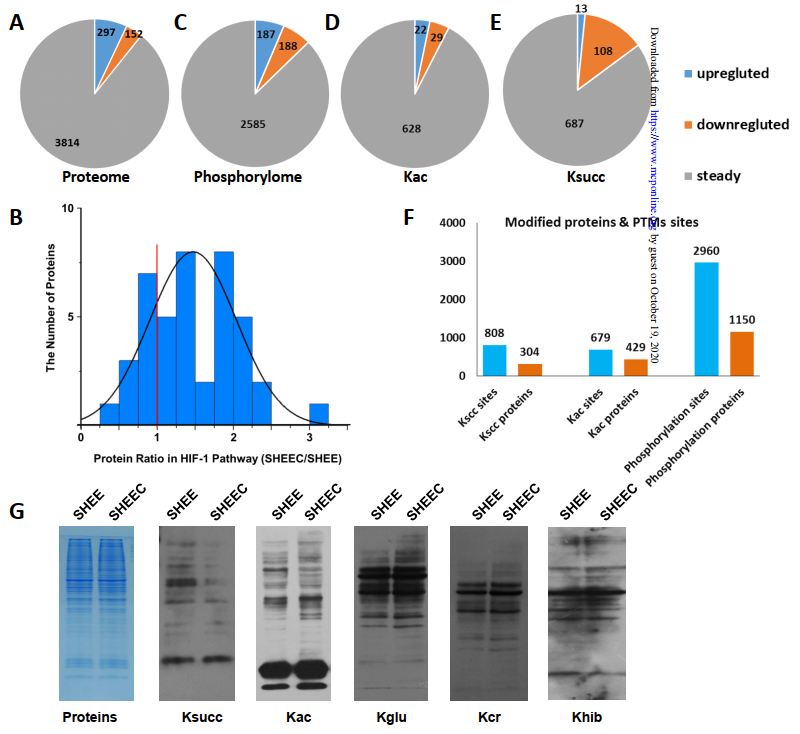
1、定量蛋白质组学分析表明,恶性SHEEC细胞中琥珀酰化修饰显著降低
首先,本研究建立了稳定的细胞模型:永生但非恶性的人类食管上皮细胞系SHEE及其恶性转化的对应物SHEEC,二者是研究ESCC肿瘤发生最适宜的细胞模型。使用基于SILAC的蛋白质组学定量技术对SHEE和SHEEC细胞系进行分析,共定量到3,814种蛋白质。在差异表达的蛋白质中,作者得出了很多与ESCC相关的已知功能因子
(如Ezrin、GRB2和RB1)
以及已知作用通路
(如HIF-1信号传导、糖酵解和氧化磷酸化)
。
其中,SHEEC细胞中HIF-1信号转导途径被激活,可能是受蛋白质磷酸化、赖氨酸乙酰化和赖氨酸琥珀酰化的调节。
所以作者接下来研究了细胞系模型中的这三种PTM形式。
通过对其中磷酸化、乙酰化和琥珀酰化肽进行的蛋白质组学定量分析,共鉴定到7,588个磷酸化位点
(2,708个蛋白质)
、755个乙酰化位点
(489个蛋白质)
和879个琥珀酸化位点
(358个蛋白质)
。通过归一化筛选蛋白质后定量发现,SHEEC细胞系中差异性变化的琥珀酰化位点中绝大多数显著下调
(13个上调,108个下调)
。Western blot进一步验证了这一结果,表明
赖氨酸琥珀酰化的减少是ESCC细胞中PTM改变的独特且特定的形式
(图1)
。通过GO、KEGG、STRING分析,表明大多数琥珀酰化下调的蛋白质都参与了TCA循环。
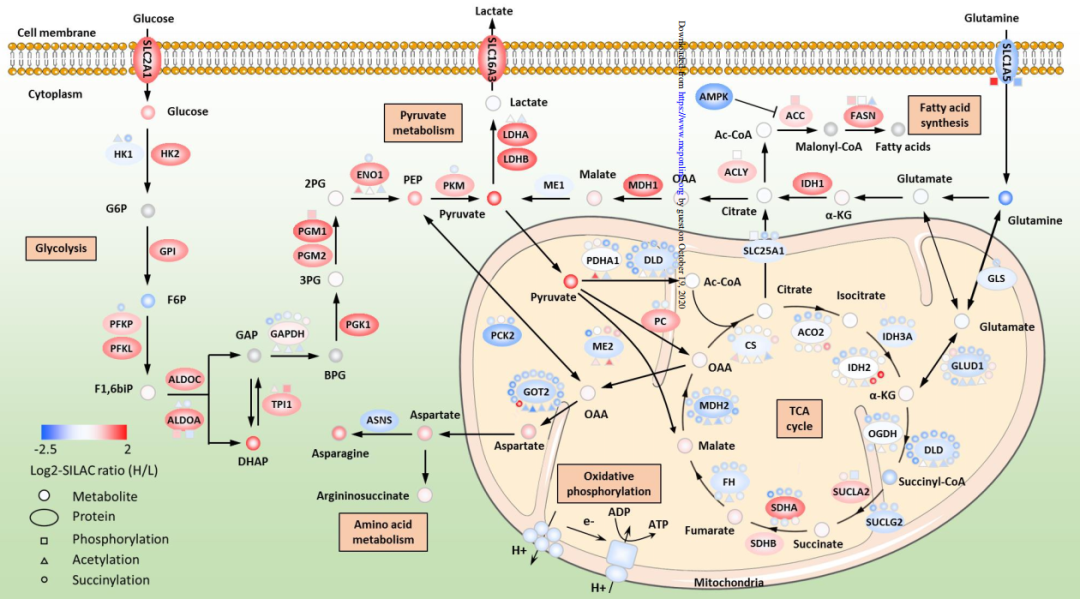
通过靶向代谢组学方法表明,SHEEC细胞系中糖酵解、丙酮酸代谢和脂肪酸合成中代谢酶及代谢产物积累
(图2)
,而TCA循环中只有SDHA、SUCLA2以及代谢产物琥珀酰辅酶A显著上调,其他并无变化。此外,果糖二磷酸醛缩酶A
(ALDOA)
的活性显著增强,表明SHEEC厌氧呼吸增强,这与癌细胞的温格伯效应一致。
图2 SHEEC细胞中异常的代谢途径
(红色代表上调,蓝色代表下调。糖酵解途径中大多数蛋白质被上调,而TCA循环中大多数赖氨酸琥珀酰化被下调)
那么,是什么导致了ESCC细胞中赖氨酸琥珀酰化修饰的显著降低呢?排除“eraser” 脱琥珀酰酶SIRT5的影响
(因为SHEEC和SHEE中,SIRT5蛋白质和mRNA的表达相似)
,作者猜测可能是由于琥珀酰-CoA的相对丰度降低引起的。
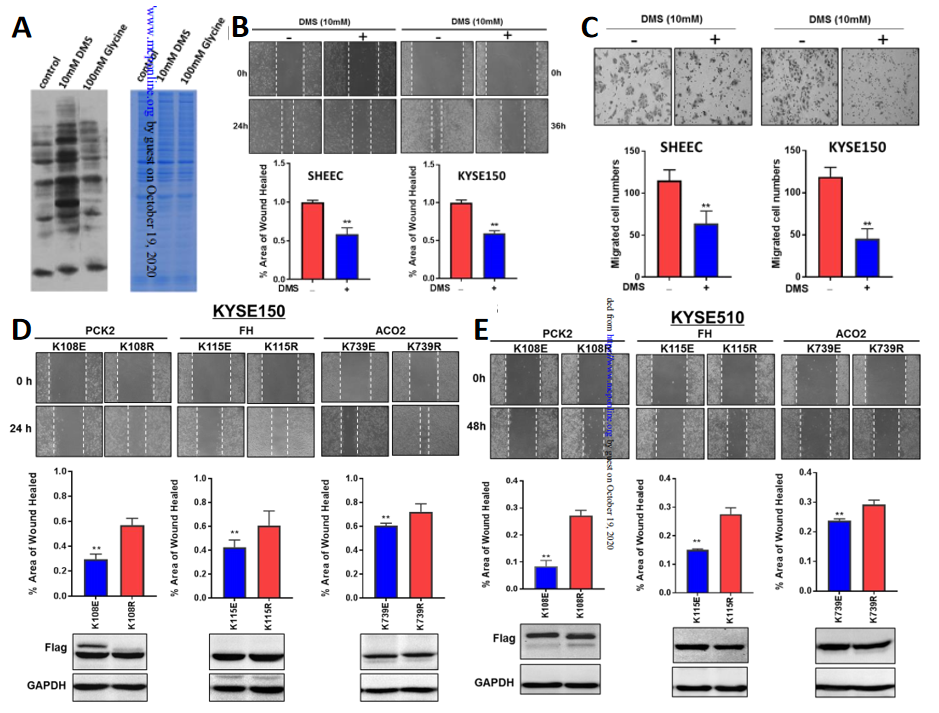
3、使用DMS提高赖氨酸琥珀酰化,可抑制SHEEC细胞迁移
除TCA循环外,下调的琥珀酰化作用还富集于涉及肿瘤生物学的其他途径,包括氧化磷酸化、丙酸酯和脂肪酸代谢,这些代谢途径与调节肿瘤的迁移有关。作者在SHEEC细胞中人为添加了琥珀酸二甲酯
(DMS)
来提高赖氨酸琥珀酰化的整体水平
(图3A)
,发现
随着赖氨酸琥珀酰化的增加,SHEEC细胞的迁移能力被有效地抑制
(图3B,C)
,这表明低琥珀酰化可能促进了ESCC细胞迁移的能力。
随后作者选取三种SHEEC中据报道可调节肿瘤表型的次琥珀酰化蛋白,包括磷酸烯醇式丙酮酸羧基酶2
(PCK2)
、线粒体乌头酸水合酶
(ACO2)
和富马酸水合酶
(FH)
进一步验证了赖氨酸琥珀酰化在癌细胞生物学中的机制,证明了当引入三个脱琥珀酰化的突变体中的任何一个时,KYSE150和KYSE510细胞系的迁移能力均受到抑制
(图3D,E)
,进一步表明了
赖氨酸琥珀酰化可能通过调节蛋白质底物改变ESCC细胞的迁移。
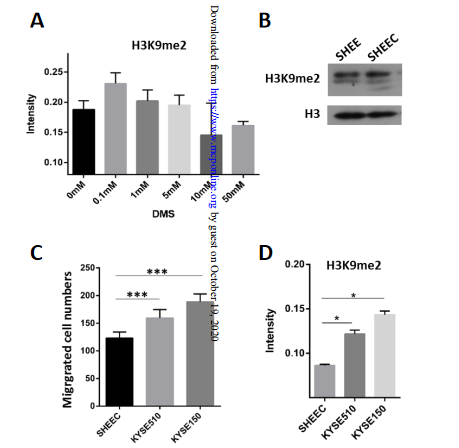
4、低琥珀酰化负调节组蛋白H3K9me,增强SHEEC细胞迁移能力
组蛋白PTM通常在癌症的发展中起重要作用。研究者进行了各种浓度的DMS缓冲液刺激SHEEC细胞,并使用了DIA质谱法对组蛋白PTM进行分析。结果表明,SHEEC细胞中琥珀酰化水平随着DMS浓度的增加而上调,而H3K9me2则显示出类似的下降趋势
(图4A)
。
这表明琥珀酰化可能对H3K9me2具有负面的调节作用。
通过蛋白质印迹,研究者又发现SHEEC中H3K9me2的表达高于SHEE细胞中的表达
(图4B)
,这与两种细胞系中的琥珀酰化表达相反,进一步表明在SHEEC细胞中琥珀酰化对该组蛋白标记的负调节作用。
那么,琥珀酰化修饰对组蛋白标记的负调控作用,对抑制肿瘤细胞迁移意味着什么?通过检查三种食道癌细胞系
(SHEEC,KYSE510和KYSE150)
的迁移能力,并测量了H3K9me2的水平,作者发现SHEEC、KYSE510和KYSE150细胞系的迁移能力越来越强
(图4C)
,H3K9me2的水平也相应地上调
(图4D)
。即表明,
低琥珀酰化作用可能通过上调组蛋白PTM水平,使SHEEC细胞迁移能力增加。
图4 低琥珀酰化负调节组蛋白H3K9me2,增强细胞迁移能力
5、DMS抑制ESCC细胞在体内的生长、迁移和侵袭
最后,作者探讨了赖氨酸琥珀酰化在体内ESCC侵袭中的作用。使用裸鼠进行了相关实验,
结果表明DMS通过提高赖氨酸琥珀酰化作用来抑制ESCC细胞在体内的生长、迁移和侵袭。
在成对的人类ESCC样品
(n=106)
及与相邻的非恶性食道上皮
(n=97)
中,也证实了上述观点。
本篇研究确定了异常的蛋白质和翻译后修饰
(PTM)
途径,发现赖氨酸琥珀酰化修饰在癌细胞中显著下调,其富集在癌症代谢的关键通路酶上,特别是在TCA循环的代谢酶中,这种低琥珀酰化作用可能归因于琥珀酰辅酶A的减少。重要的是,琥珀酰化水平的恢复会抑制ESCC的细胞迁移。同时,研究发现琥珀酰化对组蛋白甲基化具有负调节作用,可以促进肿瘤细胞迁移,也在原发性ESCC标本中证实了低水平的琥珀酰化。
以上结果表明,赖氨酸琥珀酰化作用可能会改变ESCC的代谢和迁移,从而为PTM在癌症生物学中的功能意义提供了新的见解。
本研究中的乙酰化修饰组学和琥珀酰化修饰组学由景杰生物提供技术支持,感谢天津医科大学
张锴
教授课题组的信任和大力支持!
乙
酰化
修饰
(Acetylation)
是指在乙酰基转移酶的催化下,把如乙酰辅酶A的乙酰基团转移并添加在蛋白质赖氨酸残基上的过程。乙酰化修饰参与了所有主要的生物学过程,如基因转录、细胞周期、DNA损伤修饰、细胞信号转导等,并且可通过多种机制影响蛋白质功能,包括调节蛋白质稳定性、酶活性与亚细胞定位等,涉及癌症、神经性疾病、代谢疾病等多种人类疾病。
琥珀酰化
(Succinylation)
是指琥珀酰基供体通过酶学等方式将琥珀酰基团共价结合到赖氨酸残基的过程。相比于甲基化和乙酰化,琥珀酰化修饰能够引发更多的蛋白质特性的改变。
琥珀酰化广泛参与
代谢调节、表观遗传、信号转导
等众多生物学过程,与
肿瘤、心血管系统疾病、炎症
等疾病密切相关。
1. Song, Y. M., et al. 2014. Identification of genomic alterations in oesophageal squamous cell cancer. Nature.
2. Lin, D. C., et al. 2014. Genomic and molecular characterization of esophagealsquamous cell carcinoma.
Nat Genet.
3. Zhenchang Guo, et al. 2020. Systematic Proteome and Lysine Succinylome Analysis Reveals the Enhanced Cell Migration by Hyposuccinylation in Esophageal Squamous Cell Cancer.
Mol Cell Proteomics.
本文由景杰学术团队报道,欢迎转发到朋友圈。如有转载、投稿、等其他合作需求,请文章下方留言,或添加微信ptm-market咨询。
#关注领取
新人福利
,下载最近三年影响因子(后台发送关键词“新人”)





 个人中心
个人中心
 我是园区
我是园区




