医谷微信号:yigoonet
近日,荣昌生物发布公告称,公司建议向中国相关监管机构申请配发及发行不多于5442.63万股A股,以及建议向上海证券交易所申请批准A股在科创板上市及买卖,如若此次荣昌生物冲击科创板成功,“A+H股”将再添一员,截止2020年10月,生物医药领域已有13家A+H股上市公司,包括白云山、复旦张江、上海医药、复星医药、药明康德、君实生物、康希诺、海普瑞、泰格医药等。

荣昌生物成立于2008年,是一家发现、开发和商业化同类首创和同类最佳药物的生物制药公司,其重点布局自身免疫、肿瘤、眼科等领域,具体的生产管线包括单克隆抗体、融合蛋白、ADC、双功能抗体等,根据荣昌生物官网显示,截止目前,其产品管线包含了10种药物,包括2款融合蛋白药物,以及4款ADC药物。

其中,融合蛋白双靶点药物泰它西普(商品名:泰爱)已于今年3月获得国家药监局批准上市,用于“在常规治疗基础上仍具有高疾病活动的活动性、自身抗体阳性的系统性红斑狼疮(SLE)成年患者”的治疗,这也是荣昌生物实现商业化的首个产品。
现阶段,泰它西普在国内市场的唯一竞争对手是葛兰素史克的贝利尤单抗(商品名:倍力腾),其于2019年在华上市,但贝利尤单抗仅针对BLyS一个靶点,而泰它西普作为目前全球唯一一个获批治疗SLE的双靶点生物制剂,可以同时抑制BLyS和APRIL两个细胞因子,使用融合蛋白技术,使得药物与两个细胞因子的亲和力更强,实现更高效抑制,从而达到“双管齐下”的治疗效果,在增加有效性的同时也提升药物的安全性。今年4月,泰它西普率先在山东挂网,挂网价为5172元/盒。按照每周给药一次,在不算赠药的情况下,患者年治疗费用约26.89万。
据了解,目前,全球有超过20款治疗系统性红斑狼疮的在研抗体药物。其中,除了已上市销售的贝利尤单抗和泰它西普,进展较快的还包括阿斯利康的Anifrolumab,已在中国获批临床,在中国境外已进入3期临床开发阶段。
此外,泰它西普还在加速海外商业化进程,美国FDA已授予其快速审批通道的资格,正在启动临床III期试验,在国内对于其他适应症的临床试验开发也在同步进行中,包括类风湿关节炎、视神经脊髓炎谱系障碍、IgA 肾病、重症肌无力、干燥综合征和多发性硬化症等。
除了泰它西普,荣昌生物另外一款较受关注的药物是ADC药物注射用纬迪西妥单抗(代号:RC48 商品名:爱地希),其上市申请已获得国家药监局正式受理,并被拟纳入优先审评审批程序申请适应症可能为HER2表达的胃癌,这也是目前国内ADC药物进展最快的产品,其有望成为首个获批的国产ADC药物。
近几年来,ADC药物作为一种融合了小分子药物细胞毒性和抗体靶向作用的强效抗癌药物,填补了抗体药物和传统化疗药物之间的空白,有利于提高药物的特异性并改善治疗窗口,在近几年已逐渐成为主流生物药,来自美通社的预测显示,2025年ADC药物市场规模将达到99.3亿美元,复合年增长率有望将达到25.9%。
截止目前,全球共有11个款ADC药物获批,包括辉瑞的Mylotarg、Besponsa,罗氏的Kadcyla、Polivy、阿斯利康的Lumoxiti等,均为国外产品,不过,国内的ADC药物研发局面也竞争激烈,有二十多种处于不同阶段临床试验中的ADC药物正在开发中,包括东曜药业、恒瑞医药、科伦药业、云顶新耀、浙江医药等多个公司有产品已经进入临床阶段,除了大多数针对HER2靶点外,其他靶点包括c-Met、EGFR、Trop-2、CD20、BCMA等。
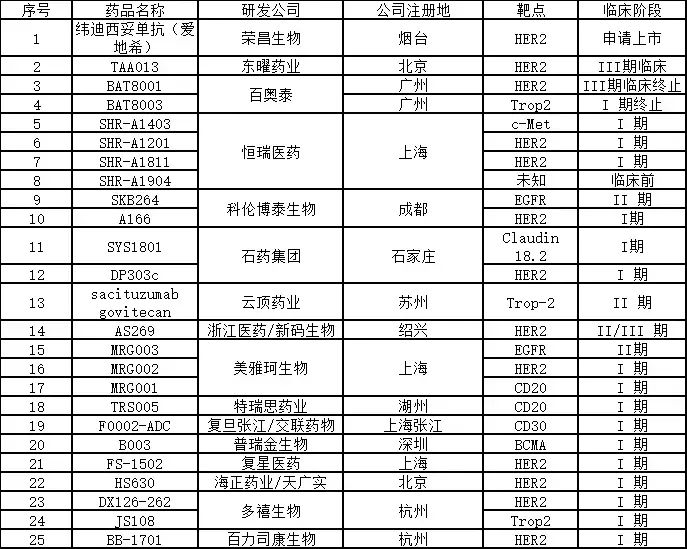
国内ADC药物研发情况 医谷制图
虽然有多款前景较好的产品,但由于目前只有1款产品实现了商业化,目前荣昌生物依然处于亏损状态,荣昌生物财报显示,2018年、2019年和2020年,荣昌生物净亏损分别为2.7亿元、4.3亿元、7亿元;研发费用分别为2.16亿元、3.52亿元和4.7亿元。其绝大部分经营亏损均归因于研发开支、行政开支及财务成本。
但此次荣昌生物登陆科创板,并非公司缺钱,其2020年财报显示账上现金为28亿元,其早前也透露计划在科创板上市,充裕的现金主要是用来支持临床试验项目的开展。
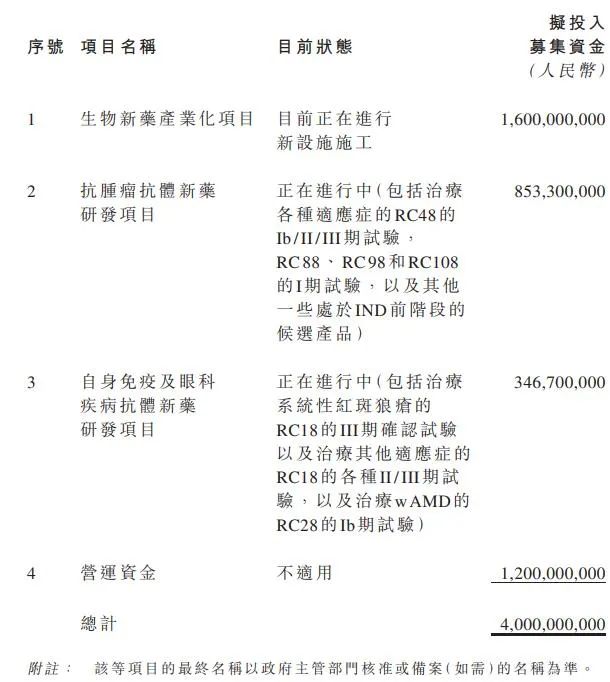
根据荣昌生物公告,其此次赴科创板上市计划募集资金总计约40亿元,将主要用于生物新药产业化项目、抗肿瘤抗体新药研发项目、以及自身免疫及眼科疾病抗体新药研发项目。
文 | 医谷
(第三轮通知),点击这里报名>>





 个人中心
个人中心
 我是园区
我是园区




