
导言
昨日,中国国家药品监督管理局(NMPA)正式批准其肿瘤免疫创新药物阿替利珠单抗(商品名:泰圣奇®,Tecentriq®)联合贝伐珠单抗(以下简称“T+A”联合疗法)用于治疗既往未接受过系统治疗的不可切除肝细胞癌(HCC)患者。
此次获批为中国肝癌患者带来了希望。获批依据源于III期临床试验IMbrave150的研究结果,其中包括对194名中国亚群患者的分析。早在今年5月,《新英格兰医学杂志》就公布了PD-L1抑制剂阿替利珠单抗联合抗血管生成药贝伐珠单抗临床III期试验IMbrave150的完整数据:与目前的标准治疗索拉非尼相比,阿替利珠单抗联用贝伐珠单抗能够显著延长晚期肝癌患者的总生存期(OS)和无进展生存期(PFS),一年生存率达到67.2%,宣告"阿替利珠单抗+贝伐珠单抗联合治疗成为晚期肝细胞癌一线治疗的新标准。”
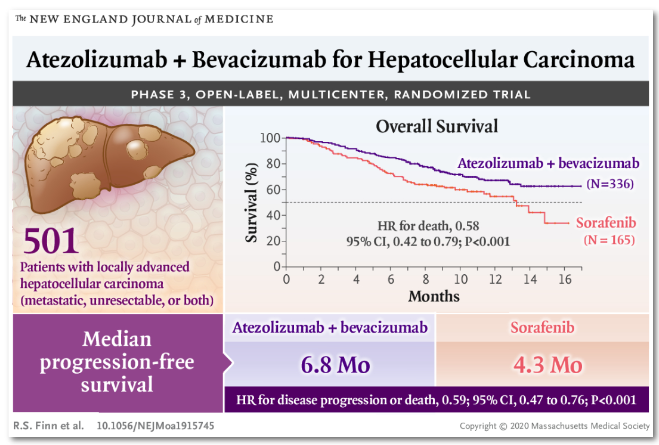
图片来源于NEJM医学前沿
此项研究的重要作者领星科学顾问委员会成员,哈佛大学医学院教授,嘉会国际肿瘤中心主任Dr. Andrew Zhu曾表示:“肝癌的发生过程很复杂,其中也有很多免疫微环境的改变,各种肝癌的致病因素”,在中国人群中肝癌的发病诱因和基因可能有它的独特之处,导致以往很多项研究在国内因“水土不服”而终止。而IMbrave150研究分析的是入组的所有中国患者的数据,其显示中国患者可以从“T+A”联合疗法中获得更好的治疗效果!主要体现在:“第一,它相对总存活期是延长的;第二,它对无进展生存期也是延长的;第三,它对肿瘤缓解率是增加的;第四,从安全角度来说,非常令人满意,两药联合的方案实际跟单药的索拉非尼对比之后,结果出乎意料,并没有出现一些更严重的副作用;而且最重要的是,两药联合方案,对病人的生活质量方面的评估结果表明,可明显改善患者的生活质量”。
早在中国获批之前,“T+A”联合疗法已经全球多款临床指南推荐成为晚期肝癌患者的一线治疗方案,包括ESMO、NCCN指南等,中国的CSCO指南也进行了推荐。
免疫治疗和抗血管治疗的联合方案是借助对肝癌发生机制的探索而达成的共识,它对于肝癌治疗格局具有变革性意义,是其发展道路上突破性的进展,是改变肝癌这一重大难治性肿瘤的有效临床实践。

参考文献
1. 罗氏阿替利珠单抗免疫联合治疗方案在中国获批用于一线治疗肝细胞癌(罗氏制药)
2. CSCO原发性肝癌诊疗指南(2020版)
3. Atezolizumab plus bevacizumab in unresectable hepatocellular carcinoma




 个人中心
个人中心
 我是园区
我是园区




