疫苗的安全性要求非常高,因为它们是用于健康人的。因此,疫苗开发既耗时又非常昂贵。缩短上市时间对于制药公司来说是关键,可以挽救生命,并节省金钱。因此,需要系统的、通用的和有效的工艺开发策略来缩短开发时间并增强对工艺的理解。高通量技术极大地增加了与工艺相关的有用数据量,结合统计和机械建模,新的高通量工艺开发(HTPD) 方法不断发展。引入基于模型的 HTPD 可以更快、更广泛地筛选条件,并进一步增加知识。基于模型的 HTPD 对于层析法尤其重要,而后者是获得高纯度的关键分离技术。
本综述将介绍生物制药行业中使用的下游工艺开发策略和工具,重点关注疫苗纯化工艺。随后将根据实验工作和理解,对高通量工艺开发和其它组合方法进行讨论和比较。在不断增长的信息海洋中,新型建模工具和人工智能(AI) 对于发现数据背后的模式并因此获得更深入的工艺理解变得越来越重要。
在 2019 年 12 月首次爆发之后,COVID-19大流行席卷全球,已经造成数百万人丧生,并且每天仍在感染数十万人。世界比以往任何时候都更加意识到疫苗的价值,其有助于改善公共卫生、降低医疗保健成本、支持经济增长、旅行安全和延长预期寿命。总体来说,疫苗接种估计每年可预防2-300 万儿童和近 600 万成人死亡。最近,世界卫生组织发布了一项行动计划,让世界上每个人都可以接种疫苗,并促进疫苗行业的创新。
下游工艺在将疫苗中的污染物浓度降至极低值方面发挥着关键作用。这可以防止例如高反应原性和不需要的免疫反应,并保证疫苗的安全性和有效性。设计疫苗纯化工艺伴随着许多决策,例如纯化技术的类型和顺序、条件、成本和其它性能测量。此外,优化单个单元操作和整体纯化顺序很重要,而一个步骤中条件的微小变化可能会影响后续单元操作性能。高安全性和纯度要求导致疫苗纯化工艺的复杂性增加。这通常伴随着低生产力和工艺能力,使得下游工艺在成本和时间上都非常昂贵。开发疫苗纯化工艺的主要挑战之一是分离与产品密切相关的关键杂质,例如蛋白质抗原疫苗中的宿主细胞蛋白(HCP) 或者DNA或RNA疫苗中的基因组DNA 或 RNA。另一个挑战是在纯化过程中保持抗原结构以及抗原稳定性,因为大多数抗原易受温度、pH或盐浓度变化的影响。
鉴于传染病爆发和竞争激烈的市场,快速的疫苗工艺开发至关重要,这在很大程度上取决于其纯化工艺的设计策略。传统上,疫苗是在10 到 15 年内开发出来的,因此制药公司希望在各个方面都大幅缩短工艺开发时间。第一个 SARS-CoV-2 疫苗可以在 1-2 年内开发出来的原因之一是,由于阶段的并行化而不是顺序开发,实现了加速的开发时间线。如此快速发展的其它原因是应用了相关病毒和现有疫苗的先前知识和生产工艺(即平台知识),以及能够实现并行化和快速监管审查的广泛可用的政府资金。
“质量源于设计” (QbD) 范式使制药行业从试错法转向更全面、系统和高效的方法,目的是增加对工艺的理解和过程控制。高通量工艺开发(HTPD) 方法的实施有助于更快、更高效的工艺开发,另外降低材料消耗,并提高成本效益。HTPD是高通量实验 (HTE) 和建模技术的组合方法。最近Sao Pedro等人概述了HTPD 中的主要问题领域(例如细胞培养、过滤和分析工具),以及建议的解决方案(微流体、建模和过程分析技术(PAT)),以实现集成式连续生物生产。虽然本文不主要关注连续生物生产,但目前HTPD 的局限性同样适用于疫苗纯化工艺的开发。
疫苗纯化工艺彼此之间可能存在巨大差异,因为它们在很大程度上取决于疫苗的类型和起始材料/宿主生物体(例如鸡胚、细菌细胞、哺乳动物细胞和昆虫细胞)。Carvalho等人指出了疫苗类型对下游工艺策略的影响,并详细描述了每种疫苗的纯化步骤,重点是流感疫苗。图 1显示了疫苗类型的一般概述,分为完整病原体(灭活或减毒)、病原体的抗原成分(亚单位)或核酸疫苗。
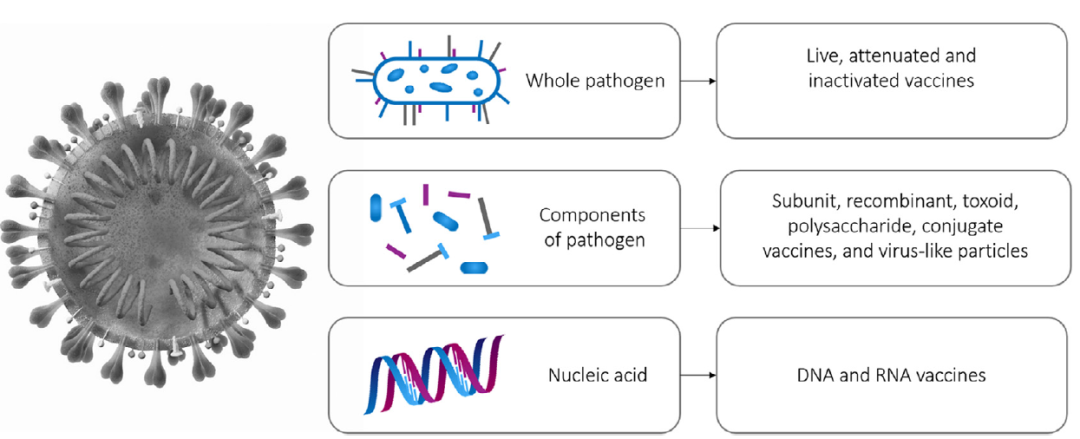
图1. 疫苗种类分为完整病原体、病原体抗原成分和核酸疫苗。
为了保持活疫苗和灭活疫苗的遗传稳定性,下游工艺仅包含几个步骤。蛋白质重组疫苗或亚单位疫苗的纯化涉及复杂的纯化挑战,因为存在与目的蛋白密切相关的HCP。最近Jones等人指出了高风险 HCP 的担忧,并推荐了一种监测和消除已知杂质的策略。尽管不同蛋白质亚单位疫苗下游工艺之间存在很大差异,但纯化步骤的一般顺序如图 2所示。如果抗原(目标产物)在细胞内产生,则纯化过程需要细胞裂解步骤,而如果抗原存在于细胞外,则不需要此步骤。特定疫苗类型的详细纯化方案超出了本文的范围,可以在其它文章中找到。例如,Josefsberg和 Buckland 描述了几种基于病毒的偶联和 DNA 疫苗的生产过程,而Abdulrahman 和 Ghanem 总结了纯化质粒 DNA 疫苗的最新进展。在Wen等人的书中,对病毒疫苗纯化和蛋白质亚单位疫苗纯化进行了更详细的描述。
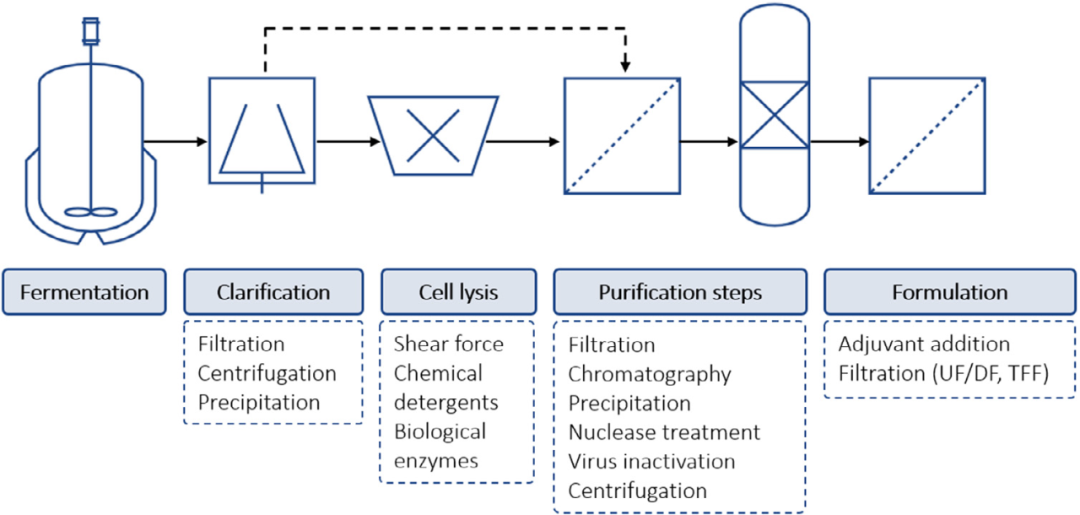
图2. 疫苗的一般工艺流程,包括从发酵到最后制剂步骤的上游和下游部分。不同类型疫苗的工艺在每个单元操作下面给出。实线表示抗原在细胞内产生的纯化工艺,包括细胞裂解。虚线表示不需要细胞裂解的细胞外产物的纯化工艺。
目前大多数疫苗开发方法都是基于实验设计(DoE),其中多个因素同时改变以评估潜在的相互作用,从而获得一个多维模型,将各种因素对关键质量属性(CQA)的影响关联起来,这是 QbD 指南中的一个重要方面。然而,现有的疫苗工艺开发策略需要大量的实验工作,并且通过它获得的工艺理解很少。此外,纯化步骤的顺序确定以及各步的工艺优化可能导致相对于目标(例如产量或成本)的次优工艺设计。像为单克隆抗体(mAb) 所建立的标准化方法(也称为平台工艺)在疫苗中仍然缺失,这主要是由于疫苗类型之间存在很大差异。即使只考虑蛋白质亚单位疫苗,由于表达系统的多样性,就已经可以看到非常多样化的蛋白质范围。
针对特定疫苗类型的平台工艺在工艺开发时间、知识、资源、成本和监管方面将非常有益。另一个通常较为复杂的任务是病毒或细菌颗粒的精确定量检测和表征,由于缺乏快速分析技术,其会进一步复杂化。QbD倡议的一个趋势是使用 PAT,它允许实时测量,以确保一致的产品质量和性能,同时提供对工艺的更好理解。机械模型依赖于在某个分离步骤中发生的物理过程,因此对于过程理解非常有用,但也减少了实验工作量,并允许在计算机上执行不同规模的工艺。人工智能技术的使用可以消除建模领域的不足,使建模技术的适用性和可用性更高。
本文将介绍现代和未来的下游工艺开发方法及其在生物制药工业中的应用,重点是层析法,因为这是蛋白质亚单位疫苗的主要纯化技术。本文旨在通过使用更先进的建模技术(如经验、机械和混合建模)来展示基于模型的高通量工艺开发方法的演变。工业界和学术界的案例研究支持使用这些方法的适用性和益处。
下游工艺开发方法
工艺开发的总体目标是设计最佳的纯化工艺,通过以最小的成本和时间,努力实现纯度目标,同时遵守所有法规要求。目前,疫苗开发主要采用基于DoE 的方法,但它也可以受益于更先进的、基于模型的工艺开发方法,这些方法已经用于其它生物制药领域,例如mAb 的纯化。图 3 显示了两种类型的工艺开发方法,基于 DoE 的方法和基于建模的方法。在下文中,将简要介绍工艺开发方法。

图3. 两种不同工艺开发方法概述。左:实验设计(DoE)方法,基于统计工具进行实验,并通过统计分析评估结果。这种方法通常应用于生物制药行业。右:基于模型的工艺开发方法,通过有针对性的实验确定模型输入参数,如等温线参数和柱参数。在执行优化之前,必须对模型进行验证。
原文:D.Keulen,G.Geldhof, O.L.Bussy, et al., Recent advances to accelerate purification processdevelopment: a review with a focus on vaccines. Journal of Chromatography A,2022, https://doi.org/10.1016/j.chroma.2022.463195.




 个人中心
个人中心
 我是园区
我是园区





