▎药明康德内容团队编辑
今日,Cara Therapeutics和Vifor Pharma联合宣布,美国FDA已经批准Korsuva(difelikefalin)上市,用于治疗接受透析的慢性肾病(CKD)成人患者的中重度瘙痒。Korsuva是一款“first-in-class” κ阿片受体(KOR)激动剂,靶向外周神经系统。新闻稿指出,这是用于治疗这一患者群体的首款FDA批准的疗法。

这一批准是基于两项关键性3期临床试验的结果,以及从32项临床研究中获得的支持性数据。在两项关键性3期临床试验中,Korsuva达到了试验的主要终点,与安慰剂相比,更多接受Korsuva治疗的患者在评估瘙痒的WI-NRS评分上改善超过3分。
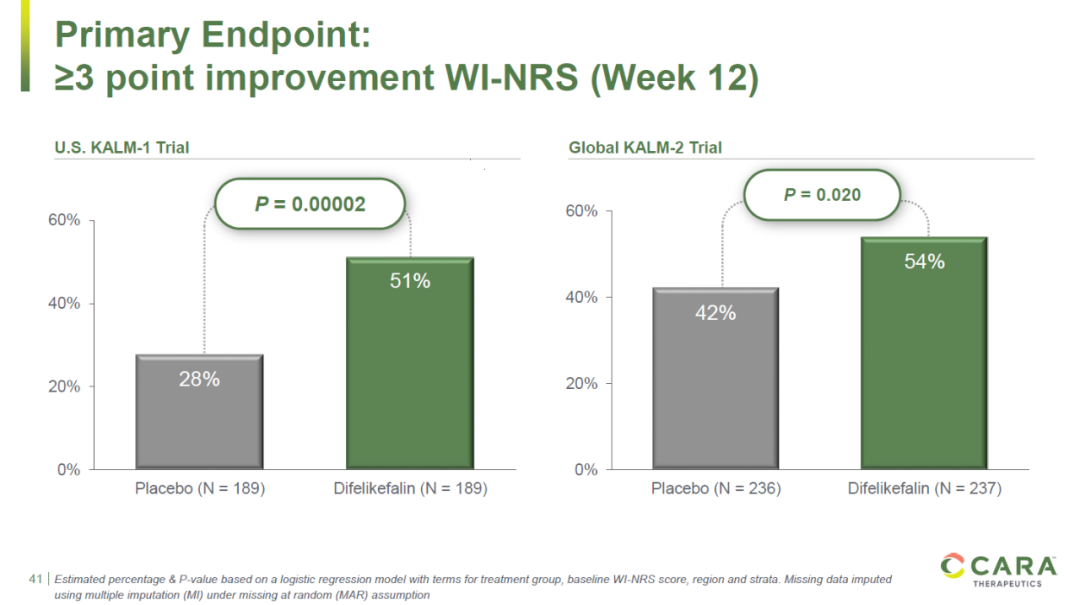
▲Korsuva在两项关键性3期临床试验中达到主要终点(图片来源:Cara Therapeutics公司官网)
Korsuva是一款“first-in-class” κ阿片受体(KOR)激动剂,它直接抑制产生瘙痒的外周神经元的活性,因而可以用于缓解由于多种原因造成的瘙痒。目前它还在临床试验中用于治疗多种其它疾病造成的瘙痒。
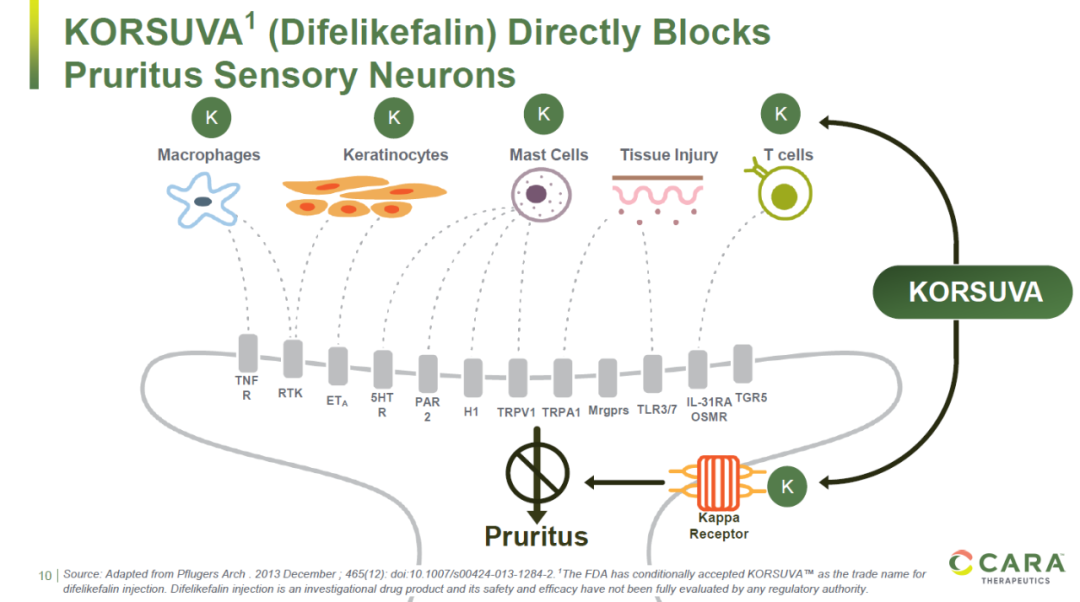
▲Korsuva的作用机理(图片来源:Cara Therapeutics公司官网)
“FDA批准Korsuva对于受到中重度瘙痒困扰的很多透析CKD患者来说是个显著的进步。” Cara Therapeutics总裁兼首席执行官Derek Chalmers博士说,“我们对参与临床试验的患者,研究人员和我们的员工表示由衷的感谢。”
Vifor Pharma首席执行官Abbas Hussain先生说:“我们相信Korsuva能够改变对这一患者群体的治疗模式。我们将致力于与Cara Therapeutics一起,尽快将这一‘first-in-class’疗法带给患者。”
参考资料:
[1] Cara Therapeutics and Vifor Pharma announce U.S. FDA approval of KORSUVA™ (difelikefalin) injection for the treatment of moderate-to-severe pruritus in hemodialysis patients. Retrieved August 23, 2021, from https://www.globenewswire.com/news-release/2021/08/23/2285085/29236/en/Cara-Therapeutics-and-Vifor-Pharma-announce-U-S-FDA-approval-of-KORSUVA-difelikefalin-injection-for-the-treatment-of-moderate-to-severe-pruritus-in-hemodialysis-patients.html
注:本文旨在介绍医药健康研究进展,不是治疗方案推荐。如需获得治疗方案指导,请前往正规医院就诊。
版权说明:本文来自药明康德内容团队,欢迎个人转发至朋友圈,谢绝媒体或机构未经授权以任何形式转载至其他平台。转载授权请在「药明康德」微信公众号回复“转载”,获取转载须知。








 个人中心
个人中心
 我是园区
我是园区




