CAR-T细胞治疗使血液系统恶性肿瘤的治疗模式发生了革命性的变化。到目前为止,已经开发了Kymriah、Yescarta、Tecartus等CAR-T药物,并取得了前所未有的疗效。然而,一些患者可能会在之后复发,这推动了对克服CAR-T细胞耐药性和复发机制的深入研究,目前已经取得了显著的技术进步。如纳米抗体和CRISPR-Case9,以确保CAR-T细胞疗法充分发挥其医疗潜力。本文概述了CAR-T细胞疗法的发展和开发原理,总结了不同CAR-T细胞药物在疗效上的异同以及相应的临床效果,并讨论了CAR-T免疫疗法与其他药物疗法联合应用的临床效果。
一、背景
近年来,肿瘤治疗方法发展迅速,尤其是免疫治疗是发展最快的癌症治疗方法之一。CAR-T细胞免疫治疗在癌症治疗中取得了惊人的治疗效果,正成为恶性血液病的关键治疗选择。
虽然CAR-T细胞免疫治疗可以显著改善临床疗效,但也会带来一些安全性和有效性相关的挑战,特别是CAR-T细胞治疗在用药后的毒性,如两种主要并发症细胞因子释放综合征(CRS)和免疫效应细胞相关神经毒性综合征(ICANS)(CAR-T相关的脑病综合征(CRES)。此外,还可能发生其他严重的不良反应,包括肿瘤溶解综合征和肿瘤靶外毒性(脱靶毒性)。
即使存在这些问题,CAR-T细胞疗法仍然是一个充满前景的治疗手段。为了提高治疗效果,目前已经开发了许多优化策略,包括调节CAR-T细胞的活性、与免疫检查点阻断抗体或小分子抑制剂联合使用。CAR-T免疫疗法展示出比单一药物疗法更好的临床效果。
二、CAR-T细胞免疫治疗的机制及进展
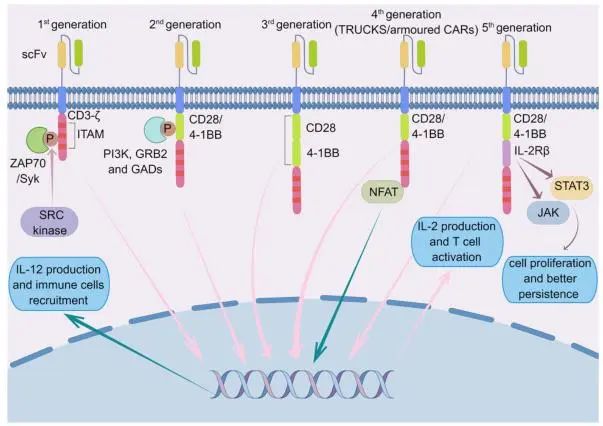
图 1五代CAR-T细胞作用机制 (作者:Figdraw)
Eshhar等人首先设计了CAR-T细胞技术来表达抗原受体。到目前为止,CAR结构(CARs)已经经过了五代发展。
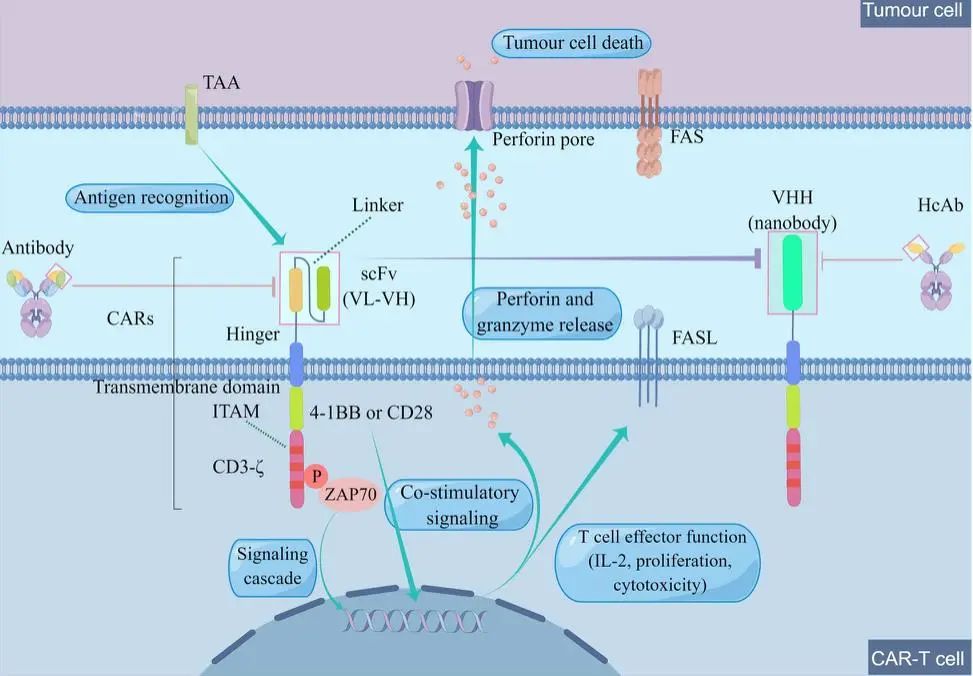
图 2 CAR-T疗法的机制。CAR-T治疗的机制一种单抗通常用于产生CARS的胞外部分。识别TAA的单链抗体由VL区和VH区组成。除了ScFv,靶向域还使用VHH,也被称为纳米抗体,它是从HcAbs的可变域衍生的。铰链区连接跨膜区和胞外区。细胞内激活区可分为共刺激区和信号区。共刺激机制产生的信号依赖于共刺激结构域(CD28依赖于PI3K,而4-1BB使用NF-κB和TRAF)。CD3-ζ通常是一个含有三个ITAM的信号区。一旦单链抗体识别并结合TAA,ITAM的磷酸化就通过ZAP70启动信号转导,然后发出信号释放T细胞反应(颗粒酶和穿孔素/BID或FADD)。(作者:Figdraw)
CAR-T细胞主要依赖于工程化CARS,表现出抗原特异性和T细胞杀伤作用。当CAR-T细胞识别特定的TAA(肿瘤相关抗原)时,ITAM(免疫受体酪氨酸激活基序)通过磷酸化作用启动,促进增殖,释放细胞因子并增强免疫反应。但这种约束机制有一定的局限性。TAAs(如CD19或CD20)的表达缺失是肿瘤耐药性产生的关键机制之一。此外,与肿瘤特异性抗原(TSA)不同,TAA选择性较低,在肿瘤上过度表达,但在正常器官和组织上也表达,导致脱靶效应并引起安全问题。
细胞毒性通常通过两大途径发挥作用:
(1)CAR-T细胞分泌颗粒酶和穿孔素是抑制肿瘤进展(主要途径)
(2)通过激活凋亡信号通路刺激癌细胞的凋亡,包括激活BH3相互作用结构域死亡激动剂(BID)和FAS相关死亡结构域蛋白(FADD)。
三、CAR-T免疫治疗的临床疗效
这一部分总结了用于治疗血液系统恶性肿瘤的前沿商业CAR-T药品的最新研究进展。
1
Kymriah (Tisagenlecleucel)
Kymriah是FDA在2017年批准的第一个CAR-T细胞产品(CD19/FMC63),用于治疗B细胞前体急性淋巴细胞白血病(B-ALL)难治性或二次或以后复发的患者(25岁以下)。次年,Kymriah获批用于治疗成人复发/难治性大B细胞淋巴瘤(R/R LBCL)。
在Juliet(NCT02445248)II期试验中,111例R/R LBCL患者接受输液。ORR(客观缓解率,肿瘤缩小的保持时间的病人比例)为52%,CR率为40%。最常见的CRS和ICAN是最常见的不良反应,发生率分别为56%(22%≥3级)和21%(12%≥3级)。与其他药物比较,Kymriah3级以上CRS的发生率相对较高。
2022年5月27日,Kymriah被FDA批准用于治疗经过二线或二线以上系统治疗的成人R/R FL患者的新适应症。这一批准是基于全球2期Elara试(NCT03568461),标志着Kymriah拥有了第三个适应症,扩大了治疗的疾病范围。
但在白细胞分离过程中,与淋巴细胞聚集在一起的循环肿瘤细胞可能无意中被CARS转导,这可能通过肿瘤细胞表达的CARS与同一细胞上的TAA结合而导致抗原掩蔽,导致体内克隆性增殖和肿瘤细胞逃逸。
2
Yescarta (Axicabtagene Ciloleucel)
Yescarta(Axicabagene Ciloleucel,KTE-X19)是第二代逆转录病毒转导的基于CD-28的CAR-T细胞产品(CD19/FMC63),于2017年10月18日获得FDA批准,用于治疗成人R/R LBCL患者,包括DLBCL、原发性纵隔B细胞淋巴瘤(PMBCL)、HGBCL和转化滤泡性淋巴瘤(TFL)。在一项关键的1/2期研究Zuma-1(NCT02348216)中,101名患者接受了Yescarta输注,ORR和CR分别为83%和58%。
根据Zuma-5(NCT03105336)的结果,FDA于2021年3月3日批准了成人R/R FL患者在两个或更多系统治疗后的适应症。2022年4月1日,美国食品和药物管理局批准将Yescarta用于治疗在一线化疗免疫治疗(包括抗20单抗和蒽环类药物)后12个月内出现R/R,并打算进行大剂量的自体干细胞挽救治疗的成人LBCL患者。在Zuma-7(NCT03391466)试验中,ORR和CR分别为83和65%。
最近的研究(Zuma-12)也证明Yescarta作为成人高危LBCL一线治疗的安全性和有效性。2021年6月,Yikaida(FKC876)的商标在中国获批。
3
Tecartus(Brexucabagene)
Tecartus(Brexucabagene Autolucel)是第三种CAR-T细胞药物(CD19/FMC63),于2020年7月24日首次获准用于治疗R/R套细胞淋巴瘤(MCL)患者。作为一项关键的2期临床试验,Zuma-2(NCT02601313)纳入了所有接受BTK抑制剂预治疗的MCL患者,他们的ORR为93%,CR为67%。该药的ORR较高,但3级以上ICAN的发生率达到31%,居同类药物之首。
2021年10月1日,FDA批准Tecartus用于治疗26岁及以上的R/R B-ALL成人患者。在Zuma-3(NCT02614066)2期试验中,55名患者接受了输液。其中39例(71%)出现CR或CR伴血液学不完全恢复。49例(89%)患者出现任何程度的CRS,其中≥3级13例,占24%。33例(60%)患者出现任何级别的ICAN(25%≥3级,14例患者)。
在制造方面,与Yescarta相比,Tecartus涉及T细胞选择和淋巴细胞富集,包括移除患者白细胞分离材料中周期性表达CD19的肿瘤细胞。MCL患者的起始样品中T细胞相对较小,而外周血中存在大量循环正在循环的肿瘤细胞和白血病母细胞。因此,移除这些细胞可能有助于提高成功率。
与前身Yescarta相比,Tecartus在ORR和CR方面均有改善,但CRS和ICAN的发生率也在3级以上。但如果Tecartus的毒性得到控制,它将是治疗血液系统肿瘤的理想药物。
4
Breyanzi (Lisocabtagene Maraleucel)
2021年2月5日,Breyanzi(Lisocabagene Maralecel)(CD19/FMC63)被FDA批准用于经过两个或两个以上的系统治疗(包括GBCL、PMBCL和3B级FL)的成人R/R LBCL患者,批准基于Transcend NHL 001(NCT02631044)的结果,旨在验证Breyanzi对R/R LBCL和MCL患者的疗效和安全性。在256名患者中,ORR 为73%,CR为53%,预估的一年有效率为65%。CRS发生率为42%(≥等级3,2%),ICAN发生率为30%(≥等级3,10%)。
2022年6月25日,FDA批准Breyanzi用于治疗R/R LBCL。这次批准是基于第二阶段试点试验(NCT03483103)和关键第三阶段改造试验(NCT03575351)的结果。
在Transform试验中,90例患者接受了输液。有效率为86%(79例),有效率为66%(61例)。49%的患者发生了CRS(只有1例患者有3级CRS)。12例患者(≥分级3级,4%)出现了ICANS。
与其他CAR-T细胞产品相比,Breyanzi含有一个非功能性的tEGFR,tEGFR与CD19特异性CAR在细胞表面共表达,因此可以作为CAR表达的替代品。在Breyanzi的制造过程中,从白细胞分离材料中挑选CD8+和CD4+T细胞,然后独立激活、转导和扩增。
制造过程中会产生克隆多样化、分化较少的纯T细胞产品(记忆T细胞)和低于量化水平的CD19+细胞。此外,CD8+和CD4+CAR-T细胞能以1:1的比例回输。这种固定转移剂量能加强对毒性的控制,从而提高持久性和扩增能力。
与使用其他药物时CRS和ICAN的3级以上发生率相比,Breyanzi具有更高的安全性和持久性。
5
Abecma (Idecabtagene Vicleucel)
Abecma(Idecabagene Vicleucel,bb2121)是FDA于2021年3月26日批准的第一个CAR-T细胞药物(BCMA/C11D5.3)。该产品可用于治疗经过四线或更多治疗(免疫调节剂、蛋白酶体抑制剂和抗CD38单抗)的成人R/R MM患者。
共有140名被诊断为R/R MM并接受上述三种治疗的患者参加了KARMMA(NCT03361748)第二阶段研究。ORR和CR出现率分别为73%和33%。84%的患者出现了CRS,其中5%的患者发生3级或以上的反应。此外,18%的患者出现ICAN,其中3%为3级,无3级及以上神经毒性发生。
与其他产品相比,Abecma在3级及以上不良反应发生率方面有明显改善,但CR仍有提高的必要。
6
Carvykti (Ciltacabtagene Autoleucel)
作为2022年2月28日FDA批准的首个中国CAR-T细胞疗法(BCMA/VHHVHH),Carvykti是全球第二个针对BCMA的CAR-T细胞疗法。与以往的CAR-T产品不同,Carvykti含有两个单域VHH抗体(VHH-VHH),大大增强了对靶细胞表面BCMA的亲和力。
启动了1b/2期临床研究CARTITUDE-1(NCT03548207),以评估Carvykti的安全性和临床活性。在最新的数据中,97名患者的有效率为97.9%,部分缓解(VGPR)为94.9%,严格完全缓解(SCR)为82.5%。首次缓解、最佳缓解和≥完全缓解的中位时间分别为1.0、2.6和2.9个月。从原始数据的角度来看,Carvykti 似乎比Abecma更好。
7
Relmacabtagene Autoleuce
Relma-Cel(JWCAR029)(CD19/FMC-63)作为二线及以上治疗方案适用于DLBCL患者。转导的自体CD4+和CD8+T细胞在Relma-cel中表达tEGFR和CD19特异性CARS。其表达的CAR结构与另一种CAR-T细胞产物Breyanzi(CD19/4-1BB/CD3-ζ)的结构类似。Breyanzi有很高的应答率。
在2期临床试验(NCT04089215)中,59例接受输液的患者中,47.5%的患者出现CRS,而CRS>3级的患者为5.1%。各等级的ICAN发生率为20.3%,3级以上ICAN的发生率为5.1%。ORR为75.9%,CR为51.7%。本试验证明Relma-cel 治疗R/R期LBCL的疗效与 Breyanzi相当,相关毒性低,疗效好。
8
其他CAR-T产品
自体BG1805(抗CLL1 CAR-T)被FDA授予治疗AML的孤儿药物(罕见药)称号。CLL1在儿童AML细胞和白血病干细胞中高表达,而在正常造血细胞中低表达。在I期临床试验(ChiCTR1900027684)中,11名R/R AML(急性髓系白血病)儿童接受了BG1805治疗。体内扩增高峰时间的中位数为8天,这表明CAR-T细胞扩增迅速有效。11例患儿总有效率为81.9%,总的疾病控制率为90.9%。其中10例完全缓解,CLL1+AML癌细胞在1个月内消除。5例CR和微小残留病阴性(MRD−),3例CR和MRD+,1例部分缓解(PR),1例病情稳定(SD)。11例患者检测到3/4级不良反应,但未检测到剂量依赖性毒性。
一到三级CRS都有出现,但无死亡事件发生。CB-010治疗是CRISPR利用CRISPR杂合RNA-DNA(ChRDNA)技术进行基因编辑而建立的一种基于编辑的同种异体抗CD19 CAR-T细胞治疗方法。
基因编辑技术属于chRDNA技术。与CRISPR-Cas9相比,chRDNA具有高度的特异性和较低的非靶点编辑水平,允许多基因编辑和插入。CB-010治疗包括三个方面的基因编辑:
(I)定点敲除CD19CAR进入T细胞;
(II)敲除TRAC基因(T细胞受体α的恒定区)以去除TCR(T细胞(抗原)受体。
(III)敲除编码PD-1的基因。在它的第一次临床试验中,Cariou Biosciences报告说,5名可评估的患者的ORR和CR分别为100%和80%。在这项试验中,在治疗3个月后,4名患者出现CR,最长持续6个月。与以前的CAR-T细胞疗法相比,初步临床数据显示ORR和CR显著增加,CB-010质量剂量较低也更安全。
三、CAR-T免疫联合疗法
CAR-T细胞免疫疗法在恶性B细胞治疗中的应用已显示出一定的应用前景,但在实体恶性肿瘤中的作用十分有限。主要是因为CAR-T细胞存在几种耐药机制:缺乏持久性、靶点耗尽、抗原丢失和免疫抑制的TME(靶向肿瘤微环境)。
因此,本文讨论了当前靶向治疗结合CAR-T细胞治疗以克服耐药机制的试验,包括联合方案的安全性和有效性。表2列出了一些涉及联合方案的试验。
1
PD‑1/PD‑L1
目前正在对CAR-T疗法联合免疫检查点抑制剂的疗效进行评估(图3)。
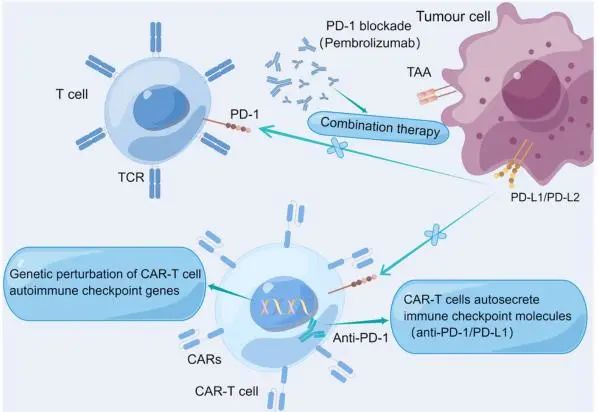
图 3 免疫检查点阻断技术在CAR-T细胞中的应用。(I)联合治疗,用pembrolizumab(抗PD-1)治疗;(Ii)CAR-T细胞自身分泌免疫检查点分子(Iii)CAR-T细胞自身免疫检查点基因的遗传扰动。(作者:Figdraw)
(I)联合疗法。临床前研究表明,CAR-T细胞的效应器功能通常被耗尽,这限制了它们的抗肿瘤活性。CAR-T细胞自我分泌免疫检查点分子。在临床前小鼠模型中,CAR-T细胞分泌针对免疫检查点的抗体。此外,这种针对免疫检查点的抗体的局部分泌可能会降低系统毒性。
(II)对CAR-T细胞自身免疫检查点基因的基因微扰,包括对CAR-T细胞进行修饰来提高其对PD-L1(程序性死亡配体1)的抵抗力,并使用CRISPR-Cas9敲除编码CAR-T细胞的PD-1基因,从而增强CAR-T细胞的体外功能和体内PD-L1+肿瘤移植瘤的清除。基因敲除方法在临床上是耐受的,Cas9编辑的CAR-T细胞在患者体内持续了9个月。
但需要注意的是,虽然检查点阻断联合CAR-T细胞治疗是一种很有前途的免疫治疗选择,但联合治疗可能不足以诱导T细胞渗透和效应功能。
2
Ibrutinib依鲁替尼
伊布鲁替尼通过抑制BTK来调节造血系统的信号通路。作用机制主要有以下两种:
(I)伊布鲁替尼直接影响T细胞。在早期的临床研究中,伊布鲁替尼具有脱靶效应,并会抑制参与TCR信号转导的ITK(IL-2诱导激酶)。但因为Th1和CD8+T细胞有RLK信号逃逸途径,这种抑制作用仅限于Th2分化的细胞。由于这种对Th2细胞的选择性抑制,CD4+T细胞可能分化为Th1亚群,并改善Th1反应。此外,还能优先扩增T效应记忆细胞亚群并增加Th17细胞数量。以及减少CD8+T细胞上PD-1和T细胞上CTLA-4的表达和降低Treg细胞/CD4+T细胞的比例;
(II)破坏免疫抑制的TME效应。慢性淋巴细胞性白血病(CLL)微环境中的许多细胞(滋养细胞和间充质基质细胞)是白血病细胞生存、免疫逃逸和增殖必需的,而伊布鲁替尼具有将CLL细胞输出次级淋巴器官的能力。伊布鲁替尼抑制白血病细胞中CXCR4(趋化因子受体CXCR4是趋化因子基质细胞衍生因子-1(CXCL12)的特异受体)的表达,以抑制其下游信号转导。当不能返回淋巴组织时,白血病细胞会被释放到血液循环中。
而CAR-T细胞在血液中靶向白血病细胞时,胞毒性会增加,也会减少CAR-T细胞的功能衰竭。
此外,BTK(布鲁顿酪氨酸激酶)的抑制作用还可以破坏细胞因子介导的肿瘤相关巨噬细胞(TAMs)向失调TAMs(肿瘤浸润巨噬细胞)中的Nacht(分子中段为NLR各成员共有的特征性结构域,NLR指NOD样受体(NOD-like receptor)或NACHT-亮氨酸重复序列受体(NACHT-LRR receptor))和LRR(N端为亮氨酸重复序列)和NLRP3(NOD样受体热蛋白结构域相关蛋白3)易位,并抑制致瘤性IL-1β的表达。伊布鲁替尼还可以下调血液系统恶性肿瘤患者CD200(OX2)的表达。
伊布鲁替尼联合CAR-T细胞治疗是增强CAR-T细胞功能的合理方法。然而,应该进行前瞻性临床试验来评估联合方案和与使用伊布鲁替尼相关的低CRS的疗效。
3
PI3K抑制剂
I3K-AKT-mTOR-c-myc抑制信号通路可促进大量具有可控细胞毒作用的CAR-T细胞的产生。
(I)已证明PI3K抑制剂可以提高CAR-T细胞的疗效。PI3Kδ通路在B和T细胞的功能中起着至关重要的作用。抑制这一信号通路可以在分离的T细胞扩增过程中抑制T细胞的分化,从而将CAR-T表型转变为分化较低的状态,不易迅速耗尽。PI3Kδ信号直接在TcR下游被激活,对T细胞的增殖和功能起重要作用。
体内:用PI3Kδ抑制剂(Idelalisib)治疗可促进CAR-T细胞的增殖,其特征是记忆T细胞室扩大,存活时间更长,肿瘤控制时间更长,并增强了对CD19+、CD33+以及Mesothelin+靶细胞的抗肿瘤活性。
体外:扩增CAR-T细胞可减少力竭标志物(PD-1和TIM-3)的表达,增加L-选择素的表达。PI3K/AKT轴也被IL-15(降低mTOR活性)、PI3K和c-myc B细胞适配器和AKT抑制抑制。
(Ii)PI3K抑制剂可降低CAR-T细胞治疗的细胞毒作用。Duvelisib是一种选择性的bis-PI3K-δ,γ,已被批准用于治疗R/RCLL和FL。
总之,抑制PI3K信号通路是产生大量CAR-T细胞的潜在途径,具有可控的细胞毒性和早期记忆表型。然而,抑制PI3K在缓解AEs中的意义仍需进一步研究。
四、CAR-T疗法的研究进展
想要在化疗后体内T细胞耗尽的晚期CLL患者中取得理想疗效,CAR-T细胞疗法面临很大挑战。最近,孔令辉等人证明BET蛋白(超末端结构域)可以破坏CLL患者T细胞的CAR表达和关键的乙酰化组蛋白功能。抑制BET蛋白抑制TET2甲基胞嘧啶双加氧酶水平,强制表达TET2催化结构域消除增强靶向BET蛋白在CAR-T细胞中的作用。
基因组编辑技术是推动CAR-T治疗进步的重要因素。通过慢病毒传递的CRISPR/Cas9可用于敲除肿瘤细胞中的内源性TCR(ETCR),以增强T细胞的自然能力。此外,CRISPR/Cas9介导的CD19-CAR-T细胞中的eTCR基因敲除可以避免移植物抗宿主病(同种异体反应)的风险,然而,CAR-T细胞的eTCR基因敲除可能会缩短反应的寿命。
CRISPR/Cas9也可以与腺相关病毒载体结合使用,以定向整合到特定位置。此外,基因组编辑技术可以用于CAR-T细胞的制造。在最近的一项研究中,研究人员为非病毒CAR-T制造开发了一种与制造实践兼容的良好工艺。研究人员开发了含有Cas9靶序列(CTS)的单链DNA同源定向修复模板,毒性较低,可将敲入效率(46-62%)和产量(>1.5×109修饰细胞)平均额外增加约两到三倍。
结语
CAR-T细胞疗法与PD-1/PD-L1、伊布鲁替尼、PI3K抑制剂和其他药物的联合治疗在血液性肿瘤治疗方面取得了显著的效果。联合治疗可以增强CAR-T细胞的功能,延缓其衰竭,抑制TME,减少细胞毒作用。因此,应进行前瞻性临床试验,以证明这些方案的可行性。最后,基因组编辑技术在CAR-T治疗中的应用正在迅速加快。基因组编辑技术(如CRISPR/Cas9)可以通过敲除内源性TCR来避免同种异体反应,并提供了一种毒性低、效率更高的CAR-T细胞开发方案。
注:本文图片均来自参考文献,如有版权问题请于公众号后台留言,我们将第一时间删除。
参考文献:Lu J, Jiang G. The journey of CAR-T therapy in hematological malignancies. Mol Cancer. 2022 Oct 8;21(1):194. doi: 10.1186/s12943-022-01663-0. PMID: 36209106; PMCID: PMC9547409.




 个人中心
个人中心
 我是园区
我是园区





