研发挑战 | 三代EGFR和ALK-TKI的耐药机制及处理方案
收藏
关键词:
药研发
资讯来源:药渡 + 订阅账号
发布时间:
2022-10-09

前言
国家癌症中心2022年发布的全国癌症报告显示:2016年我国新发肺癌病例约为82.8万例,死亡病例65.7万例,为所有癌种之最,严重危害人类健康。小分子酪氨酸激酶抑制剂(Tyrosine kinase inhibitor,TKI)如EGFR-TKI、ALK-TKI等是一类重要的NSCLC治疗药物,疗效显著且有多款为临床一线用药,但目前均面临临床耐药的挑战,亟需开发更多药物来改善耐药患者预后,助力NSCLC治疗。
作者 | betaloc

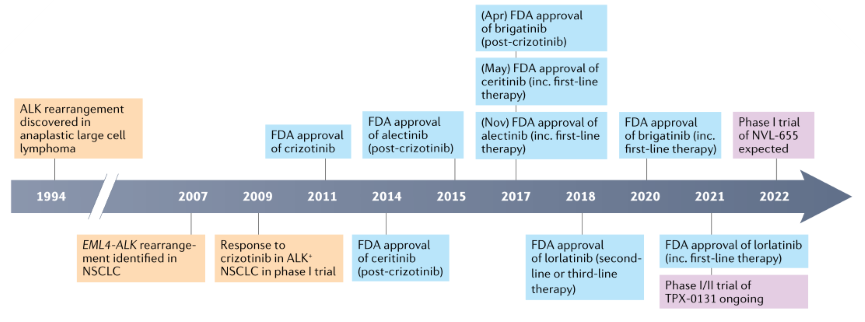
EGFR突变是中国NSCLC患者的第一大驱动基因,有51.7%的NSCLC患者为EGFR突变阳性。EGFR也是NSCLC药物开发的热点,首次鉴定于1978年, 2003年FDA即批准了全世界第一个EGFR小分子抑制剂吉非替尼,后续又有二代的阿法替尼、三代的奥希替尼等获批,截至2022年8月,全球已有共计12个EGFR-TKI获监管机构批准,但药物批准的步伐还是没有赶上耐药突变出现的脚步,一代药物上市两年后便报导了T790M突变,导致一代药物药效大打折扣,二代药物批准两年后便出现了使二代药物/三代药物均失效的C797S突变,目前医药界正致力于开发克服耐药的第四代EGFR-TKI。
ALK又被称为钻石靶点,在NSCLC患者中的阳性率约为5-7%,于1994年被首次鉴定,17年后FDA便批准了第一款针对ALK突变的克唑替尼,不就之后便出现获得性耐药,于是有了中枢渗透性更好、对克唑替尼难治患者有效的二代ALK抑制剂,如阿莱替尼、布加替尼等,二代药物也发生耐药后,三代的劳拉替尼横空出世,对一二代药物难治的患者均十分有效,但目前也已发生耐药,四代分子正处于临床开发中。

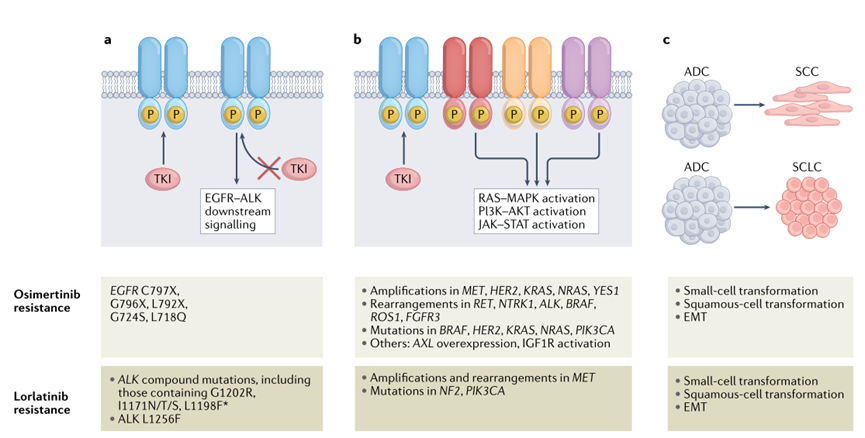
三代ALK-TKI和EGFR-TKI的耐药机制可分为靶点依赖性(on-target resistance)和非靶点依赖性(off-target resistance)两种,靶点依赖性耐药是指药物在使用一段时间后出现激酶结构域的突变,直接产生空间位阻或构象变化来妨碍TKI的结合。EGFR的C797S突变是带巯基的半胱氨酸突变为不带巯基的丝氨酸,直接将奥希替尼在蛋白上的共价结合位点抹除,致其失效,其他突变如L792X、L718X、G724S等则产生了位阻或电性排斥,让奥希替尼进入其结合口袋的难度增大。劳拉替尼耐药的主要原因则是多种点突变同时出现,如C1156Y+L1198F,I1171N+D1203N等复合突变。
非靶点依赖性耐药是指出现一种或多种旁路信号激活,上调下游信号转导蛋白表达或发生表型转换,肿瘤测序不一定能检测到这一类型的耐药。
1)旁路信号激活:发生该种类型耐药时,使用对应信号通路抑制剂即可有效克服耐药。如一线使用奥希替尼时,约7-15%的患者发生MET扩增从而导致耐药,TATTON研究显示奥希替尼与MET抑制剂赛沃替尼联用治疗该类耐药患者时,安全性好且ORR可达30%。MET扩增或重排同样可导致劳拉替尼的耐药,发生率超过20%,其他耐药旁路信号还包括RET重排、NTRK重排、BRAF重排/突变等。
2)下游信号通路再激活:虽然出现原因已经得到解析,但临床上尚未有针对该类耐药的靶向疗法。例如EGFR和ALK共同的关键下游通路RAS-MAPK,在EGFR/ALK的激酶活性被抑制时,仍可被获得性BRAF融合、KRAS突变等多种机制再激活而导致耐药,临床前模型显示联合应用MEK/ERK抑制剂能够恢复这类耐药肿瘤对EGFR TKIs的敏感性。
3)组织学表型转变:该类耐药现象需要通过肿瘤组织活检来确定,包括腺癌(ADC)向鳞状细胞癌(SCC)或小细胞肺癌(SCLC)表型的转变,以及上皮-间充质化(EMT),在劳拉替尼、奥希替尼治疗后进展的患者中均可观察到。发生表型转变后肿瘤增殖不再依赖原来的EGFR或ALK通路,侵袭性加强,从而导致药物失效,因此耐药后及时进行二次组织活检是非常必要的,以帮助临床医生根据不同的转化表型选择不同的治疗方式。

对于出现全身进展的耐药患者,需要根据耐药的原因来换用不同的治疗方案/药物,对靶点依赖性耐药的患者,可换用新一代的TKI或新型疗法如ADC、双抗等,非靶点依赖性的患者则可通过联合其他治疗药物来克服耐药。
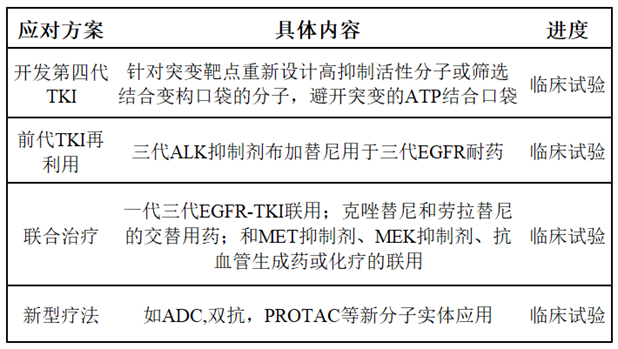
为了克服EGFR和ALK蛋白突变导致的耐药,已有多款第四代TKI正处于研究中, ATP竞争性抑制剂BLU-945和BLU-701均在临床前表现出耐药克服潜力,能够有效抑制L858R-T790M-C797S三突变EGFR,已经入I/II期临床试验;TPX-0131和NVL-655则是新一代的ALK-TKI,对多种劳拉替尼复合耐药突变(G1202R+L1196M、G1202R+L1198F和G1202R+G1269A)均有活性,也已进入I期临床试验。
老一代TKIs再利用及联合用药也是克服三代药物靶点依赖性耐药的潜在手段。已有ALK抑制剂布加替尼联合西妥昔单抗克服奥希替尼耐药的病例报道,此外,也有多种TKI和其他药物的联合疗法处于临床研究当中,包括一代三代EGFR-TKI联用(NCT03944772)、奥希替尼和MET抑制剂赛沃替尼联用(NCT03778229)、ALK-TKI和抗血管生成药贝伐珠单抗(ESMO,未登记NCT)等。
除这些传统疗法以外,开发新的modality是克服耐药的另一选择,如ADC药物、双抗、PROTAC、治疗性肿瘤疫苗等,新形式药物甚至有同时克服多种机制耐药的潜力,比如HER3靶向的ADC药物Patritumab deruxtecan,在I期临床中对EGFR C797S突变、MET扩增、HER2突变、BRAF融合、PIK3CA突变等不同耐药突变均展现出疗效,目前正处于II期临床研究当中(NCT04619004);根据I期临床数据EGFR和MET双抗Amivantamab同样也对EGFR C797S突变耐药和MET扩增耐药等多种耐药患者起效,目前已进入奥希替尼耐药患者的III期临床。
总的来说,目前三代TKI耐药在临床上仍然是较大的挑战,患者的治疗选择有限,FDA尚未批准任何一款第四代的ALK/EGFR-TKI及其他靶向药物,但目前四代TKI及更多新型疗法均已进入人体试验,并在早期临床中取得积极进展,有望为三代TKI耐药患者带来曙光。
[1] R. Zheng, S. Zhang, H. Zeng et al. Cancerincidence and mortality in China, 2016. Journal of the National Cancer Center.2022, 2, 1–9.
[2] Si X, Pan R, Ma S et al. Genomiccharacteristics of driver genes in Chinese patients with non-small cell lungcancer. Thorac Cancer. 2021;12(3):357-363.
[3] https://pharmsnap.zhihuiya.com/
[4] Leonetti, A., Sharma, S., Minari, R. et al. Resistancemechanisms to osimertinib in EGFR-mutated non-small cell lung cancer. Br JCancer 121, 725–737 (2019).
[5] Christian D. R, Alessandro L, Goderi J.P et al.Resistance to epidermal growth factor receptor inhibition in non-small celllung cancer. Cancer Drug Resist. 2018, 1:230-49.
[6] https://clinicaltrials.gov/ct2/show/NCT05384626
[7] Journal of Clinical Oncology 2022 40:16_suppl,9017-9017
“药渡”公众号所转载文章来源于其他公众号平台,主要目的在于分享行业相关知识,传递当前最新资讯。图片、文章版权均属于原作者所有,如有侵权,请及时告知,我们会在24小时内删除相关信息。








 个人中心
个人中心
 我是园区
我是园区




