据
Insight 数据库
统计,本周(8 月 21 日-8 月 27 日)全球共有 40 款创新药(含改良新)研发进度推进到了新阶段,其中,11 款首次获批临床。从成分类别角度来看,化药有 11 款,占比约 27.5%;此外,还涉及单抗、双抗、mRNA、siRNA 等。
下面,Insight 将分别摘取国内外部分重点项目做介绍。
国内方面,本周共有 27 款创新药研发进度推进到了新的阶段,其中,申报临床 6 款,获批临床 10 款。
首次公示临床试验的
有 3
款。
来自:Insight 数据库网页版(http://db.dxy.cn/v5/home/)
本周百济替雷利珠单抗与复宏汉霖斯鲁利单抗均申报上市新适应症,用于治疗一线食管鳞癌。
百济神州: PD-1 第 11 项适应症申报上市
8 月 23 日,CDE 官网显示,百济神州递交了 PD-1 单抗替雷利珠单抗的新适应症上市申请(受理号:CXSS2200075)。值得一提的是,这已经是替雷利珠单抗在国内申报的第 11 个适应症,再次刷新了国产 PD-1 报批适应症新纪录。
根据百济既往披露的临床试验结果和预期里程碑,本次申报的适应症大概率为:联合化疗针对既往未经治疗的晚期或转移性食管鳞状细胞癌(ESCC)患者。今年 4 月份该药二线治疗食管鳞癌的适应症已经获批上市,本次又进一步在这一癌种上将治疗线数推进到了一线。
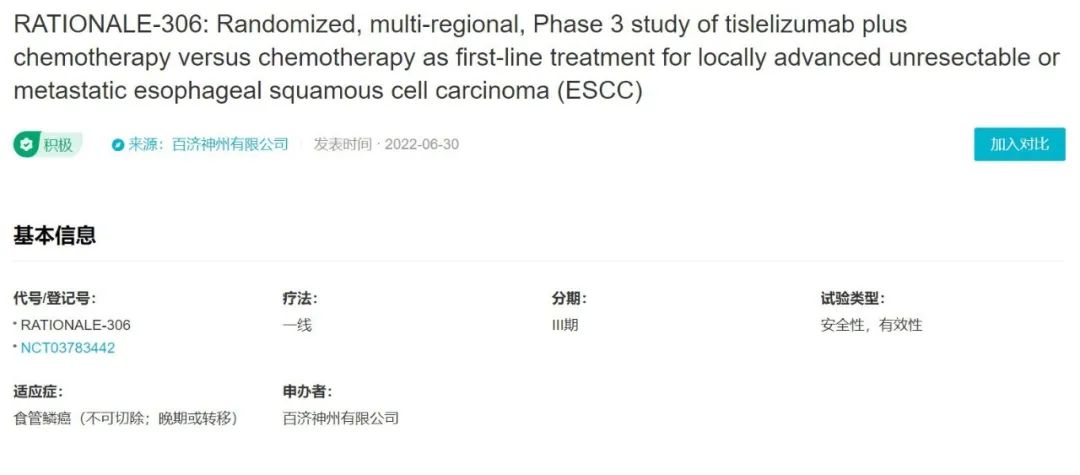
替雷利珠单抗联合化疗一线治疗局部晚期的不可切除或转移性食管鳞癌的 III 期注册临床 RATIONALE-306 研究数据,在今年 6 月 30 日的 ESMO-WCGI 会议上已经公布
(试验登记号:NCT03783442)
。试验基本信息和疗效数据详见下图:
来自:Insight 数据库网页版(点击放大,查看大图)
RATIONALE 306 研究针对食管鳞癌一线治疗,纳入亚洲、欧洲、北美及澳洲等地区共 162 家中心的 649 例患者。该药的中位总生存期(OS)达到 17.2 个月,为当前 PD-1 单抗一线 3 期研究最高值,而对照组单纯化疗的中位 OS 仅有 10.6 个月。相较之下,替雷利珠单抗延长 OS 6.6 个月,降低死亡风险达到 34%(HR=0.66)。此外无论 PD-L1 表达状态如何,替雷利珠单抗显示全球全人群生存获益。
来自:百济神州,CDE 官网,Insight 数据库整理
复宏汉霖:一线食管鳞癌!「斯鲁利单抗」第 4 个新适应症报上市
8 月 26 日,复宏汉霖递交了斯鲁利单抗的新适应症上市申请(受理号:CXSS2200076),联合化疗(顺铂+5-FU)一线治疗局部晚期╱转移性食管鳞癌 (ESCC)。
目前据 Insight 数据库显示,斯鲁利单抗已经有 4 项适应症申报上市。
今年 3 月,斯鲁利单抗首次获批上市,单药治疗经标准治疗失败的、不可切除或转移性高度微卫星不稳定型或错配修复缺陷型(MSI-H/dMMR)实体瘤,获得了今年度医保谈判的入门券;而一线鳞状 NSCLC 和一线 ES-SCLC 这两大适应症又分别在 2021 年 9 月、2022 年 4 月申报。
5 月 18 日,复宏汉霖宣布一线食管鳞癌适应症 3 期临床 ASTRUM-007在计划的期中分析中,经独立数据监查委员会(IDMC)评估达到了无进展生存期(PFS)和总生存期(OS)的双主要研究终点,于本周申报上市。
据 Insight 数据库
显示
,目前食管癌适应症国内各大主流 PD-1 单抗都已经获批,包括 K 药、O 药、四大国产 PD-1 单抗。
不过,尚无一款进入到医保目录当中,而今年这些新药都将争抢这一大适应症。
食管鳞癌患者经济负担必将大大减轻。斯鲁利单抗食管鳞癌适应症的上市申报,又将增添新的治疗选择。
齐鲁:
一线治疗宫颈癌,QL1706 新适应症启动 III 期临床
8 月 22 日,据 Insight 数据库显示,齐鲁制药 QL1706 注射液启动一项 III 期临床试验。
这是一项 QL1706 联合紫杉醇-顺铂/卡铂加或不加贝伐珠单抗用于一线治疗持续、复发或转移性宫颈癌的随机、双盲、安慰剂对照、多中心 Ⅲ 期临床研究(登记号
:CTR20222087),目标入组人数为 498 人。
QL1706 基于齐鲁自主研发的 MabPair 抗体平台开放的一款同时靶向 PD-1、CTLA-4 的抗体药。
据 Insight 数据库显示,QL1706 于 2020 年 1 月首次在国内批准临床,同年 3 月首次启动临床(登记号:
CTR20200367)。
当前 QL1706 已在
小细胞肺癌、结直肠癌、肝细胞癌、宫颈癌
等多个癌种开展临床试验。
针对宫颈癌,
在今年 ASCO 会议上,齐鲁披露了 QL1706 用于晚期鼻咽癌的疗效和安全性:1a/1b 期试验的汇总队列结果(登记号:NCT05171790)。结果表明,
QL1706 在复发和/或转移性宫颈癌患者中显示出良好的疗效和耐受性。
III 期临床试验结果积极
石药、海思科:DPP-4 抑制剂接连完成 III 期临床,拟报上市
8 月 22 日,石药集团发布公告称 1 类新药「普卢格列汀片」(DBPR108 片)
用于 2 型糖尿病治疗的两个关键临床试验均达到预设终点。
DBPR108 片为一种新型口服二肽基肽酶-Ⅳ(DPP-4) 抑制剂,对 DPP-4 具有高选择性和强抑制性。通过抑制 DPP-4,使内源性活性胰高血糖素样肽-1(GLP-1) 水平升高从而增强 β 细胞和 α 细胞对葡萄糖的敏感性,增加葡萄糖刺激的胰岛素分泌并增强葡萄糖对胰升糖素分泌的抑制作用,进而降低血糖水平。
石药在中国开展了两项 Ⅲ 期临床试验 (DBPR108 片单药 Ⅲ 期试验、DBPR108 片联合二甲双胍 Ⅲ 期试验) 作为 DBPR108 片治疗 2 型糖尿病的关键临床试验,用于支持上市申报。DBPR108 片单药及联合两项 Ⅲ 期试验共入组约 1,000 例 2 型糖尿病受试者,试验结果均显示较好的临床效果,达到预设终点。
单药试验结果显示
,在主要疗效终点第 24 周末 HbA1c 较基綫变化,DBPR108 片组优于安慰剂组,同时非劣于阳性药磷酸西格列汀片组。联合试验结果显示,在主要疗效终点第 24 周末 HbA1c 较基綫变化,DBPR108 片组显着优于安慰剂组。此外,DBPR108 片组的安全性数据显示安全性与西格列汀组和安慰剂组相似。
基于以上研究结果,石药拟于近期向 NMPA 提交上市前沟通交流的申请。
8 月 24 日,海思科宣布其 DPP4 抑制剂 HSK7653 片
已完成两项 3 期临床试验,共入组超过 900 例 2 型糖尿病受试者,初步统计分析结果均显示较好的临床效果,达到预设终点。海思科表示,将按国家药品注册的相关规定尽快向国家药品监督管理局提交上市申请,按程序注册申报。
DPP-4 抑制剂 (不含复方制剂) 在中国的市场规模逐年扩容,于 2021 年突破人民币 40 亿元,同比增长接近 25%,在海外亦呈现广阔的市场前景。当前国内这一领域被外企原研药及仿制药所占据,尚无国产创新药上市。恒瑞医药跑得最快,DPP4 抑制剂瑞格列汀 2020 年 9 月申报上市,有望在年内获批(查看审评进展)。
首次申报临床
百济神州 1 类新药申报临床:BGB-B167
8 月 24 日,百济神州的 1 类新药 BGB-B167 首次在国内申报临床(受理号:CXSL2200398)。
据 Insight 数据库显示,8 月初百济才刚刚在国外登记了 BGB-B167 的第一项 1 期临床试验,在美国和澳大利亚评估 BGB-B167 单药或联合替雷利珠单抗治疗实体瘤
(登记号:NCT05494762)。
当前,BGB-B167 的靶点和类别暂未披露。不过此前百济神州采用的新药代号暂无以 B 为开头的代号,这或许意味着 B167 可能属于临床阶段管线中尚未出现的成分类别。
百济神州的单抗药物多以 BGB-A 为代号,双抗药物则合作安进,采用 AMG 代号;化药的代号则多以 BGB- + 数字为命名格式,包括传统小分子化药以及近期申报的 PROTAC 药物。
进口药国内申报临床
礼来:自身免疫新药 PD-1 激动剂国内申报临床
8 月 23 日,礼来制药在中国申报了 PD-1 激动型抗体 Peresolimab(受理号:JXSL2200141)。这款药物被开发用于自身免疫性疾病,目前在海外已经针对类风湿关节炎和银屑病启动了临床试验。
据 Insight 数据库显示,Peresolimab(研发代号:LY3462817)的临床开发最早起始于 2018 年度,该年 10 月礼来在新加坡首先启动了一项临床试验,评估 Peresolimab 在健康人群中的安全性。当前 Peresolimab 共登记有 4 项临床试验,其中针对银屑病的 1 期临床联用了 IL17A 抑制剂 LY3509754,由于肝脏毒性已经终止;另外 2 项针对类风湿关节炎的 II 期临床仍在进行中。
礼来此前在 2021 年 12 月份的研发日中介绍了 Peresolimab 机制和潜在 First-in-class 机会,详见下图
(PPT 资料可向 Insight 数据库公众号发送「礼来 2021」下载,来自于 Immunology 部分)
。
Peresolimab 介绍:First-in-class 潜力
实际上,开发 PD-1 激动剂抗体并非仅有礼来一家。临床阶段的同类项目共有 4 款,还包括 AnaptyBio 的 Rosnilimab、强生制药的 JNJ-67484703、百时美施贵宝的 CC-90006。
本周境外共
有 15 款新药(含改良新)研发进度推进到新阶段。
其中,首个血友病基因疗法以及强生 BCMA/CD3 双抗的获批上市备受关注。
获批上市
BioMarin:首个血友病基因疗法获欧盟批准上市
8 月 24 日,BioMarin Pharmaceutical(BioMarin)宣布,欧盟委员会(EC)已批准其血友病 A 基因疗法 ROCTAVIAN™ (Valoctocogene Roxaparvovec) 有条件上市,用于治疗无 FVIII 因子抑制剂史且 AAV5 抗体阴性的严重血友病 A 成人患者。这是全球首个获批上市的血友病基因疗法。
血友病 A 也称为因子 VIII 缺乏症或经典血友病,是一种 X 连锁遗传疾病,由凝血蛋白因子 VIII 缺失或缺陷引起。血友病 A 以反复出血及其相关并发症为主要临床表现,其中约 80% 为关节出血,其并发症主要是慢性出血性关节病变,且可导致严重的关节畸形。
目前,重度 A 型血友病的护理标准是长期终身静脉输注凝血因子 VIII,但频繁的输注给患者带来极大不便。
Valoctocogene Roxaparvovec 是一款 AA5 基因疗法,通过 AAV5 将编码凝血因子 VIII 基因的功能性拷贝递送到患者体内,从而帮助患者恢复自身凝血因子 VIII 生产能力,减少持续预防性治疗需求,有潜力使患者实现一次性治疗的效果。
此次获批是基于该药物临床开发项目整体数据,包括全球性 III 期临床试验 GENEr8-1 (登记号:NCT03370913) 的结果。GENEr8-1 临床研究结果显示,与入组前一年的数据相比,单次输注 Valoctocogene Roxaparvovec 后,受试者的年出血率(ABR)显著降低,重组凝血因子 VIII(FVIII)蛋白制剂使用频率降低,患者体内血液中 FVIII 活性显著增加。在接受治疗 4 周后,受试者的年 FVIII 使用率和需要接受治疗的 ABR 分别降低了 99% 和 84%,统计学差异显著(p<0.001)。
安全性方面
,该药物在试验中安全性良好,受试者未出现 FVIII 因子抑制、恶性肿瘤或血栓副作用,也未见报告与治疗相关的严重不良事件 (SAE)。
Valoctocogene Roxaparvovec 临床试验结果
强生:全球首款 BCMA/CD3 双抗获批上市
8 月 24 日,强生宣布欧盟委员会(EC)已批准 TECVAYLI®(Teclistamab)作为单一疗法用于治疗复发和难治性多发性骨髓瘤(RRMM)成年患者,这些患者已经接受至少三种前期疗法,包括免疫调节剂、蛋白酶体抑制剂和一种抗 CD38 抗体,且患者自上次治疗后疾病仍然出现进展。这是全球首款获批上市的 BCMA/CD3 双抗。
Teclistamab 是一款完全人源化,同时靶向 BCMA 与 T 细胞表面 CD3 受体的双特异性抗体,可将 CD3 阳性 T 细胞募集至表达 BCMA 的骨髓瘤细胞附近,从而激发 T 细胞杀伤肿瘤细胞。
此次获批基于 MajesTEC-1 研究的积极结果
。这是一项开放标签、多中心、 I/II 期临床试验(登记号:NCT03145181、NCT04557098),旨在评价 Teclistamab 在复发或难治性多发性骨髓瘤患者中的疗效和安全性。
该研究共纳入 165 名患者,每周皮下注射 Teclistamab(剂量为1.5 mg/kg,递增剂量0.06 mg/kg、0.3 mg/kg)。 结果显示,总缓解率达到 63%(104/165),且 58.8%的患者获得很好的部分缓解(VGPR)以上的应答,39.4% 的患者获得完全缓解(CR)以上的应答。中位缓解持续时间为 18.4 个月,中位无进展生存期为 11.3 个月,中位总生存期为 18.3 个月。
在安全性方面,不良事件(AEs)与该患者群体一致。最常见的不良事件是细胞因子释放综合征(72%;0.6% 3 级,无 4 级)、中性粒细胞减少症(71%;64% 3 或 4 级)和贫血(55%;37% 3 或 4 级)。
免责声明:本文仅作消息分享,不代表 Insight 立场和观点,也不作治疗方案推荐和介绍。如有需求,请咨询和联系正规医疗机构。
投稿:微信 insightxb;邮箱 insight@dxy.cn
免费试用 Insight 数据库


























 个人中心
个人中心
 我是园区
我是园区




