
作者 | 野望
药品上市许可优先审评审批是国家为鼓励研究和创制新药、解决临床急需短缺药品、应对疫情突发状况等而设立的药品快速上市通道。2020年7月新版《药品注册管理办法》正式实施,对优先审评审批做了规范化安排;加之《突破性治疗药物审评工作程序(试行)》《药品附条件批准上市申请审评审批工作程序(试行)》《药品上市许可优先审评审批工作程序(试行)》等指导文件公布,药品上市许可优先审评审批工作进入了新时期。
根据规定,药品上市许可申请时,具有明显临床价值的药品可以申请适用优先审评审批程序。可分为以下6种情形。
1)临床急需的短缺药品、防治重大传染病和罕见病等疾病的创新药和改良型新药。
2)符合儿童生理特征的儿童用药新品种、剂型和规格。
3)疾病预防、控制急需的疫苗和创新疫苗;
4)纳入突破性治疗药物程序的药品;
5)符合附条件批准的药品;
6)国家药品监督管理局规定其他优先审评审批的情形。
2021年以来,我国医药产品创新热度持续升温。截至2021年10月20日,被纳入药品上市许可优先审评审批程序的药品数量达到83个(以受理号统计),包含52个产品(以药品通用名计),涉及41家企业。通过分析,我们看到以下几个特征。
药品原创性高

在52个产品中,新药上市申请达到49个,占比94%。这符合优先审评审批鼓励创新药开发的初衷。这些产品极具临床应用价值和市场价值,是药品创新发展的风向标,值得产业界重点关注。比如,豪森药业关于甲磺酸阿美替尼片用于非小细胞肺癌一线治疗的申请,百济神州关于注射用司妥昔单抗用于HIV治疗的申请等。
此外,药品多是临床急需的“救命药”。根据药品被纳入理由,以“符合附条件批准的药品”和“纳入突破性治疗药物程序”为理由纳入的药品达到29个。“附条件批准的药品”是指(1)治疗严重危及生命且尚无有效治疗手段的疾病以及公共卫生方面急需的药品,药物临床试验已有数据显示疗效并能预测其临床价值。(2)应对重大突发公共卫生事件急需的疫苗或者国家卫生健康委员会认定急需的其他疫苗,经评估获益大于风险。“突破性治疗药物”是指用于防治严重危及生命或者严重影响生存质量的疾病且尚无有效防治手段或者与现有治疗手段相比有足够证据表明具有明显临床优势的创新药或者改良型新药等。
儿童用药被重点关注

在52个药品中,因“符合儿童生理特征的儿童用药品新品种、剂型和规格”而被纳入的药品达到9个。比如瑞迪博士(北京)药业有限公司开发的氨己烯酸散,四川大冢制药有限公司开发的阿立哌唑口服溶液,长春金赛药业有限责任公司开发的重组人生长激素注射液等。
为破解“吃药靠掰、用量靠猜”的儿童用药困局,药监局开通审评审批绿色通道,加速了儿童用药上市。此外,2016-2019年,国家药监局相继发布三批鼓励研发申报儿童药品清单。2021年以来,国家药监局发布了两批说明书增加儿童用药信息的公告。
表:说明书增加儿童用药信息
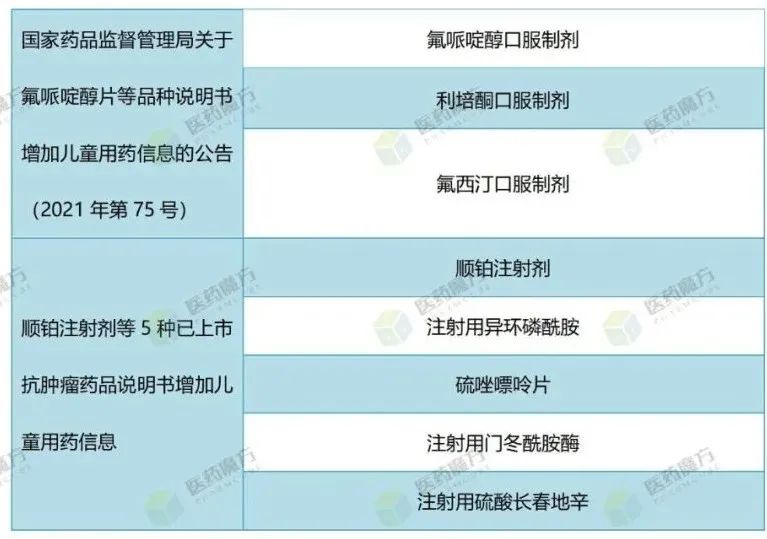
儿童药研发即将到来新的高峰期。国家药监局公布的数据显示,2020年,共批准儿童专用药和增加儿童应用的药品26个,同比增长36.8%,其中国产药品17个,增幅达到46.2%。2021年,儿童用药批准品种数量继续保持增长势头。目前已有28个儿童用药获批上市,还有45个儿童专用药和21个增加儿童适应症或用法用量品种正在审评中。
抗肿瘤药物“扎堆”

抗肿瘤药占比近7成。在52个药品中,与肿瘤治疗相关的药品高达35个,占比68%。聚焦在肺癌、肝癌、乳腺癌和白血病等临床急需的治疗领域。比如,由百济神州开发的注射用贝林妥欧单抗用于B细胞急性淋巴细胞白血病的治疗,由北京诺华制药开发的曲美替尼片用于非小细胞肺癌的治疗,由阿斯利康开发的奥拉帕利片用于前列腺癌的治疗等。
此外,治疗自身免疫性疾病的药物、罕见病用药也成为了当下企业开发的热点。比如,由艾伯维开发的乌帕替尼缓释片用于青少年中重度特应性皮炎患者,由安进生物开发的阿普斯特片用于银屑病的治疗,由新基医药开发的注射用罗特西普用于β-地中海贫血患者的治疗,由协和麒麟开发的莫格利珠单抗注射液用于蕈样肉芽肿(MF)或 Sézary综合征(SS)成人患者的治疗。
进口和国产均势竞争

进口药品仍占据数量优势。在52个药品中,进口药品32个,国产药品20个,进口药品在数量上仍占据一定优势。随着国产创新药品研发不断加强,国产新药的数量水涨船高,将与进口药品处于均势竞争的格局。
在进口药品开发企业中,不乏阿斯利康、诺华、拜耳、赛诺菲等医药巨头,同时,也活跃着信达生物、上海济煜医药、大连万春布林等本土企业,本土企业通过与外资企业合作,引进全球产品管线。
在本土药品开发企业中,活跃着贝达药业、江苏豪森药业、江苏恒瑞医药、荣昌生物、复宏汉霖等一批创新型企业。
结语

近年来,我国药品上市许可优先审评审批制度不断优化与完善,越来越多的重磅创新产品通过这一“绿色通道”加快了上市进程。这一“绿色通道”是以临床价值为导向的,抗肿瘤新药、儿童用药、罕见病用药、疫情防控疫苗等临床急需药品成为优先审评审批对象。这一“绿色通道”是开放包容的,不仅本土创新药受益,国际创新产品进入中国的速度也在加快。这一“绿色通道”是前沿与前瞻的,被纳入产品代表着当下医药的技术前沿以及未来产业发展的重点与方向。
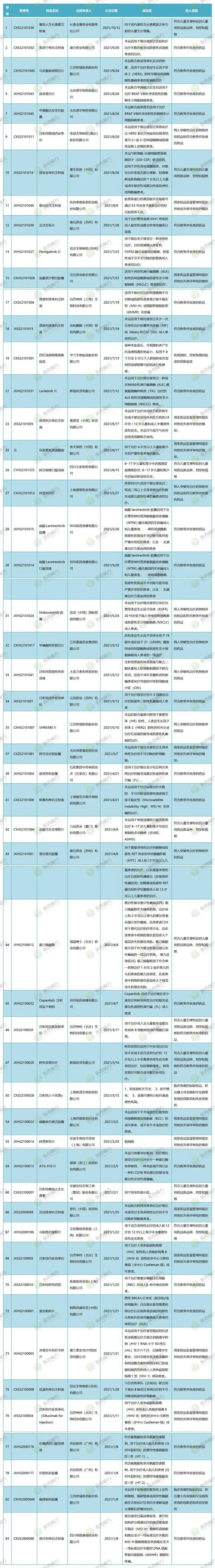
附件:2021年前三季度纳入药品上市许可优先审评审批清单(滑动、点击查看完整表单)
声明:本文仅代表作者个人观点,不代表医药魔方观点和立场,不构成任何投资和决策建议。本文版权归医药魔方所有,其他媒体转载均须事先获得医药魔方授权。欢迎投稿,具体要求和作者权益请戳下图查看。投稿邮箱:tougao@pharmcube.com。



 个人中心
个人中心
 我是园区
我是园区




