欢迎关注凯莱英药闻
10月25日,赛诺菲和再生元共同宣布,IL-4/IL-13单抗Dupilumab(商品名Dupixent)治疗嗜酸性食管炎(EoE)的第二个关键III期临床试验达到共同主要终点,是首个在临床试验中对EoE患者展示出积极疗效的生物药。双方计划将于2022年提交Dupilumab治疗嗜酸性食管炎的上市申请。

本次公布的III期临床试验为Dupilumab治疗嗜酸性食管炎(EoE)III期临床试验的B部分,共计纳入159例患者,评估每周给药一次Dupilumab 300mg(n=80)对比安慰剂(n=79)治疗EoE的安全性和有效性,共同主要终点是:治疗第24周,(1)吞咽困难症状问卷(DSQ,一种由患者报告的吞咽困难测量工具)相对基线的变化;(2)食管上皮内嗜酸性粒细胞计数峰值≤6个嗜酸性粒细胞/高倍视野(eos/hpf,食管炎症测量工具)的患者比例。
(1)Dupilumab组疾病症状减少64%、安慰剂组减少41%(p=0.0008)。疾病症状通过DSQ量表进行测量,在0-84分量表上,Dupixent治疗组改善23.78分,安慰剂组改善13.86分,p<0.0001。
(2)Dupilumab治疗组组织学疾病缓解率是安慰剂组的10倍。Dupilumab治疗组59%的患者嗜酸性粒细胞计数下降至恢复正常范围,而安慰剂组为6%,p<0.0001。
安全性方面:治疗24周,Dupilumab组和安慰剂组不良事件总发生率分别为84%(67/80)和71%(55/78)。常见不良事件(发生率≥5%)为:注射部位反应,Dupilumab组38%(30/80),安慰剂组33%(26/78);发热,Dupilumab组6%(5/80),安慰剂组1%(1/78);鼻窦炎,Dupilumab组5%(4/80),安慰剂组0%(0/78);新冠病毒感染,Dupilumab组5%(4/80),安慰剂组0%(0/78);高血压,Dupilumab组3%(2/80),安慰剂组3%(2/78)。在第24周之前,Dupilumab组3%(2/80)组和安慰剂组3%(2/78)之间未观察到因不良事件导致的停药率不平衡。
Dupilumab治疗嗜酸性食管炎(EoE)III期临床试验的A部分结果已于2020年公布,达到共同主要终点及全部次要终点,并且安全性与先前一致。
Dupilumab治疗嗜酸性食管炎(EoE)III期临床试验将继续进行,A部分与B部分中的患者将进入为期28周的长期扩展治疗,完整结果将于2022年揭晓。
嗜酸性食管炎(EoE)是一种慢性和进行性2型炎症性疾病,会损害食道并阻止其正常工作,导致吞咽困难。如果不及时治疗,症状和炎症可能会发展,导致功能受损和食道瘢痕形成。对于嗜酸性粒细胞性食管炎EoE患者来说,其需要饮食限制,并且在某些情况下需要反复医院干预。在美国,目前约有16万例EoE患者正在接受治疗,其中约48000例患者多次治疗失败。2017年,Dupilumab用于EoE的潜在治疗获得美国FDA授予的孤儿药称号。
此外,2021年10月22日,赛诺菲宣布Dupilumab治疗结节性痒疹的关键III期临床试验PRIME2达到主要终点及全部次要终点,显著减少了治疗组患者瘙痒和皮肤损伤发生,Dupilumab有望成为结节性痒疹首药。
结节性痒疹是一种慢性炎症性皮肤病,以剧痒和结节性损害为特征,临床诊断不足,可对患者造成极大的精神和情绪负担,在美国约有74000人受该疾病影响,通过局部类固醇无法有效控制疾病,目前尚无有效治疗方案获批上市。
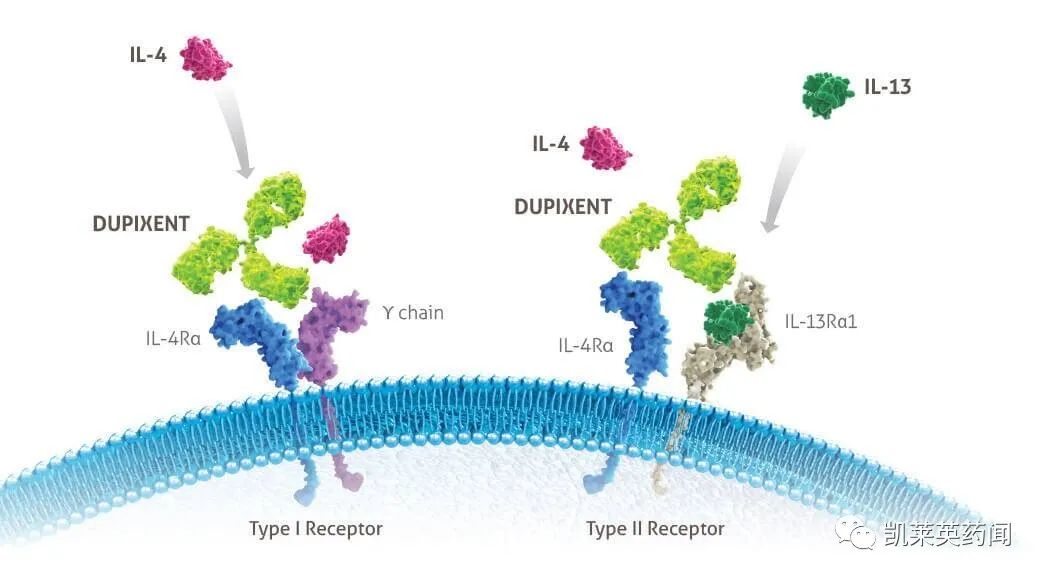
Dupilumab是一款全人源IL-4/IL-13单抗,由再生元和赛诺菲共同开发,于2017年3月首次获FDA批准上市,用于治疗成人中至重度特异性皮炎,成为首个用于治疗成人中重度特应性皮炎的靶向生物药。在中国,Dupilumab曾被纳入境外已上市的临床急需境外新药第二批名单,于2020年6月提交上市申请后,不到6个月即获批上市。
a.单独或与局部皮质类固醇疗法联合治疗局部疗法无法充分控制病情或不适用局部疗法的中度至重度特应性皮炎6岁及以上患者。
b.联合其他哮喘药物维持治疗其他哮喘药物无法控制的中度至重度嗜酸性粒细胞或口服类固醇依赖性哮喘6岁及以上患者。
c. 联合其他药物维持治疗无法控制的慢性鼻-鼻窦炎伴鼻息肉(CRSwNP)成人患者。
并且,已在美国、欧洲、中国、日本等多个国家或地区获批上市,2020年(上市第4年)全球销售额达到39亿美元,随着Dupilumab不断在新适应症中取得突破,未来将有更多适应症获批,全球销售额预计将于2025年超过百亿美元。
感谢关注、转发,转载授权、加行业交流群,请加管理员微信号“andrewmed"。
点击下方公众号名片,欢迎关注凯莱英药闻。

 药选址
药选址
