BD交易|索元生物3.13亿元引进CDE未批准生物药,研发历史超15年
收藏
关键词:
生物研发药
资讯来源:医药合作投融资联盟
发布时间:
2020-12-01
2020 年 11 月 30 日,江苏吴中实业股份有限公司全资子公司江苏吴中医药集团有限公司将其研发项目重组人血管内皮抑素注射液转让给杭州索元生物医药股份有限公司,索元生物负责区域外研发、生产、销售及以其他方式开发利用重组人血管内皮抑素注射液和诊断产品;吴中医药获得受让方独家免费许可,在区域内研发、生产和销售重组人血管内皮抑素注射液。其中“区域”指中国,包括香港、澳门和台湾。本次交易采用里程碑付款加销售提成方式,里程碑款项需在实现对应的里程碑事件后支付,里程碑款项共计 3.13 亿元人民币。
重组人血管内皮抑素注射液已在国内完成三期临床研究,2019 年 3 月,吴中医药接到了国家药监局药品审评中心的技术审评部门发出的重组人血管内皮抑素注射液(CXSS1800005-1)依据现有数据技术审评不予通过与申请人沟通交流报告的相关通知,2019 年 7 月,吴中医药向审评中心提出了药品注册撤回申请并获得批准。

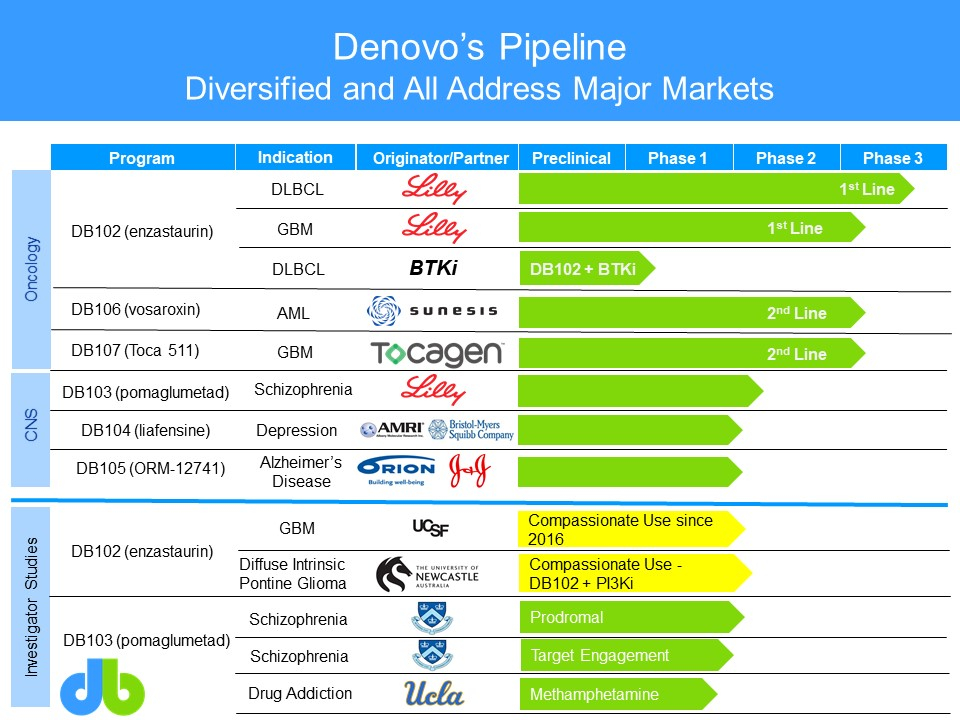
索元生物成立于 2012 年,是一家新型、以快速有效的模式开发一类新药的生物医药科技公司,主营业务为通过寻找并确定生物标记物以重新开发抗肿瘤以及精神类疾病等领域的失败新药,目前已形成了多品种且具有较大市场潜力的在研管线。索元生物目前已经拥有六个临床 IIb/III 期的创新药(DB102 - DB107),均为全球首创药物。具体来看,DB102、DB103、DB104、DB105、DB106 和 DB107 覆盖肿瘤和精神类疾病领域,原来分别为礼来、ARMI/百时美施贵宝(BMS)、奥立安(Orion)/强生、Sunesis 制药公司、Tocagen 公司开发的产品。
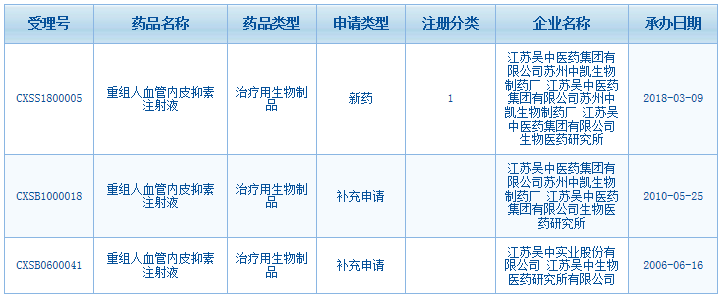
吴中医药于2005 年 7 月获得重组人血管内皮抑素注射液 I 期临床试验批件,于 2006 年 4 月完成了 I 期临床工作;2007 年 4月获得 II 期临床试验批件,于 2009 年 12 月完成了 II期临床试验;于 2011 年 3 月获得Ⅲ期临床批件,并于2011 年 6 月 30 日就该项目在北京组织召开了“临床启动会”,会后将经“临床启动会”讨论修改后的最终临床试验方案报送了组长单位(中国医学科学院肿瘤医院)的伦理委员会,并于 2011 年 9 月 29 日顺利通过了该院伦理委员会审核,正式取得了相应的批件。中国医学科学院肿瘤医院于 2011 年 10 月份首家启动了该项目的三期临床试验并接受病例入组。该项目于 2017 年 1 月 19 日完成了揭盲工作、2017 年 4 月 21 日取得了临床试验统计报告、2017 年 12 月 25 日取得了临床研究总结报告、2018 年 3 月 6 日收到了受理通知书。2019 年 3 月,吴中医药接到了国家药监局药品审评中心的技术审评部门发出的重组人血管内皮抑素注射液(CXSS1800005-1)依据现有数据技术审评不予通过与申请人沟通交流报告的相关通知,2019 年 7 月,吴中医药向审评中心提出药品注册撤回申请并获得批准。截至 2020 年 10 月 31 日,该研发项目共计已投入研发费用约人民币 7702.76 万元左右。
索元生物是一家新型、以快速有效的模式开发一类新药的全球领先型生物医药研发公司,利用全基因组扫描及独特的生物标记物研发技术在临床样本中找到可预测药物疗效的生物标记物,通过这些新发现的生物标记物作为伴随诊断来筛选患者,发现对内皮抑素敏感的肿瘤患者,从而重新开展临床试验。本次与索元生物的合作可提高新药开发的成功率,满足临床治疗需求,改善肿瘤患者生存获益,实现双方共赢。




 药选址
药选址


