▎药明康德内容团队编辑
百时美施贵宝(BMS)今天宣布,美国FDA已接受该公司为鞘氨醇-1-磷酸(S1P)受体调节剂Zeposia(ozanimod)递交的补充新药申请(sNDA),用于治疗成人中重度活动性溃疡性结肠炎(UC)。FDA同时授予这一申请优先审评资格,预计在今年5月30日前做出回复。新闻稿指出,如果获得批准,Zeposia将成为治疗UC的首款S1P受体调节剂。

溃疡性结肠炎是一种慢性炎症性肠病(IBD),其特征是长期的异常免疫应答,导致在结肠或直肠的粘膜中产生持久的炎症和溃疡。症状包括血便、严重腹泻和频繁腹痛。溃疡性结肠炎对患者的健康相关生活质量有重大影响,包括身体功能、社会和情绪健康以及工作能力。许多患者对目前可用的治疗应答不足或根本无应答。
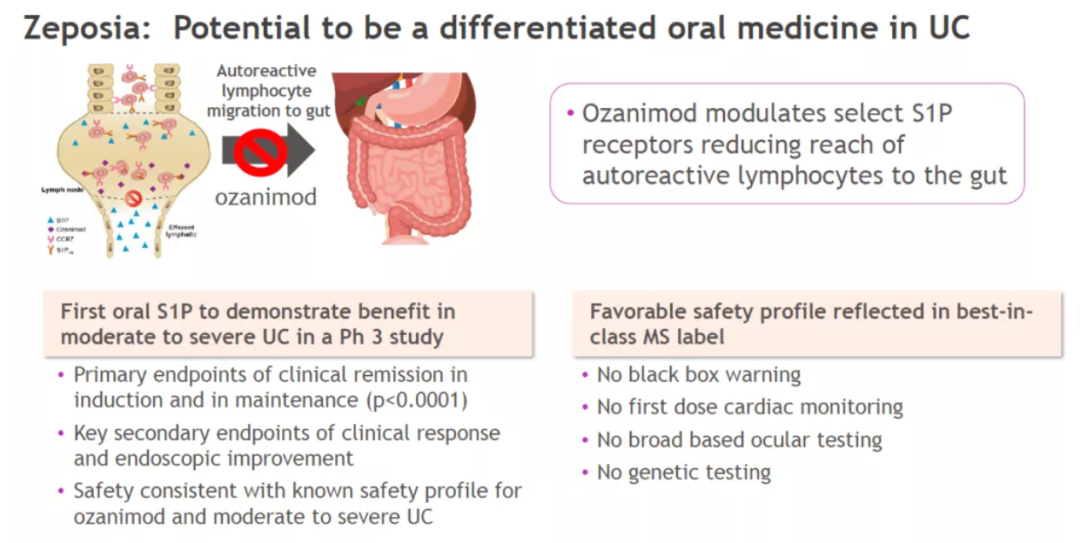
Zeposia(ozanimod)是一种口服S1P受体调节剂,以高亲和力与S1P受体1和5结合,Zeposia降低淋巴细胞离开淋巴结的能力,减少外周血中循环淋巴细胞的数量。它已经获得FDA批准用于治疗多发性硬化。目前Zeposia治疗溃疡性结肠炎的机制尚未完全得到澄清,但可能涉及减少迁移至发炎肠粘膜中的淋巴细胞数量。
图片来源:BMS官网
在名为True North的多中心、随机双盲、含安慰剂对照的3期临床试验中,对既往治疗无充分应答的中重度溃疡性结肠炎患者随机接受Zeposia或安慰剂的治疗。在诱导阶段,共有645例患者随机接受Zeposia(n=429)或安慰剂(n=216),其中分别有94%和89%的患者完成了诱导期。在维持期,457例患者被重新随机分配接受Zeposia(n=230)或安慰剂(n=227)维持治疗。其中,分别有80%和54.6%接受Zeposia和安慰剂的患者完成了研究。
试验结果显示,Zeposia不但达到试验的主要终点,这一研究还达到多项关键性次要终点,包括诱导期第10周和维持期第52周的临床应答、内镜检查改善和粘膜愈合。例如,Zeposia治疗组与安慰剂组相比,更多患者在第10周(47.8%比25.9%,p<0.0001)和第52周(60.0%比41.0%,p<0.0001)产生临床应答(clinical response)。
目前其它生物医药公司也在开发特异性S1P受体调节剂,用于治疗多种免疫介导和炎症性疾病。例如,Arena Pharmaceuticals公司开发的etrasimod是一款新一代口服S1P调节剂,它能够与S1P受体1,4,和5特异性结合,可能具有更好的疗效/安全性特征。目前,这款在研疗法临床试验中用于治疗UC,克罗恩病,特应性皮炎以及斑秃。云顶新耀(Everest Medicines)公司已经获得etrasimod在大中华区的开发权益,在中国,使用这一在研药物治疗UC患者的3期临床试验已经处于患者注册阶段。
注:本文旨在介绍医药健康研究,不是治疗方案推荐。如需获得治疗方案指导,请前往正规医院就诊。
参考资料:
[1] Bristol Myers Squibb Application for Zeposia® (ozanimod) for the Treatment of Ulcerative Colitis Accepted for Filing with Priority Review by U.S. Food and Drug Administration. Retrieved February 1, 2021, from https://www.businesswire.com/news/home/20210201005105/en
版权说明:本文来自药明康德内容团队,欢迎个人转发至朋友圈,谢绝媒体或机构未经授权以任何形式转载至其他平台。转载授权请在「药明康德」微信公众号回复“转载”,获取转载须知。




 个人中心
个人中心
 我是园区
我是园区




