您还不是认证园区!
赶快前去认证园区吧!

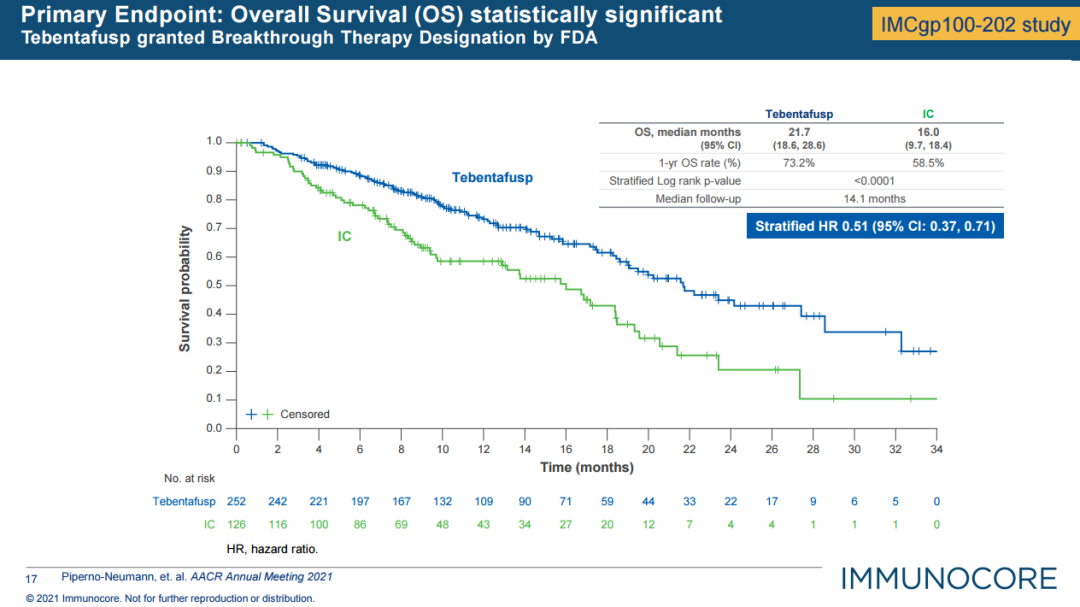
1月26日,Immunocore宣布FDA批准其双特异性融合蛋白Kimmtrak(tebentafusp-tebn),用于治疗HLA-A*02:01阳性成人转移性葡萄膜黑色素瘤(mUM)。
葡萄膜黑色素瘤是一种罕见的侵袭性黑色素瘤。虽然是成人最常见的原发性眼内恶性肿瘤,但较为罕见,全球每年约有8000例新确诊病例(美国每年1600- 2000例)。高达50%的葡萄膜黑色素瘤患者最终会发展为转移性疾病,其中47%患者为HLA-A*02:01阳性。发生转移患者通常预后不良,目前还没有公认的最佳管理或治疗方法。当癌细胞扩散到眼睛以外时,仅有约一半的患者能存活一年。
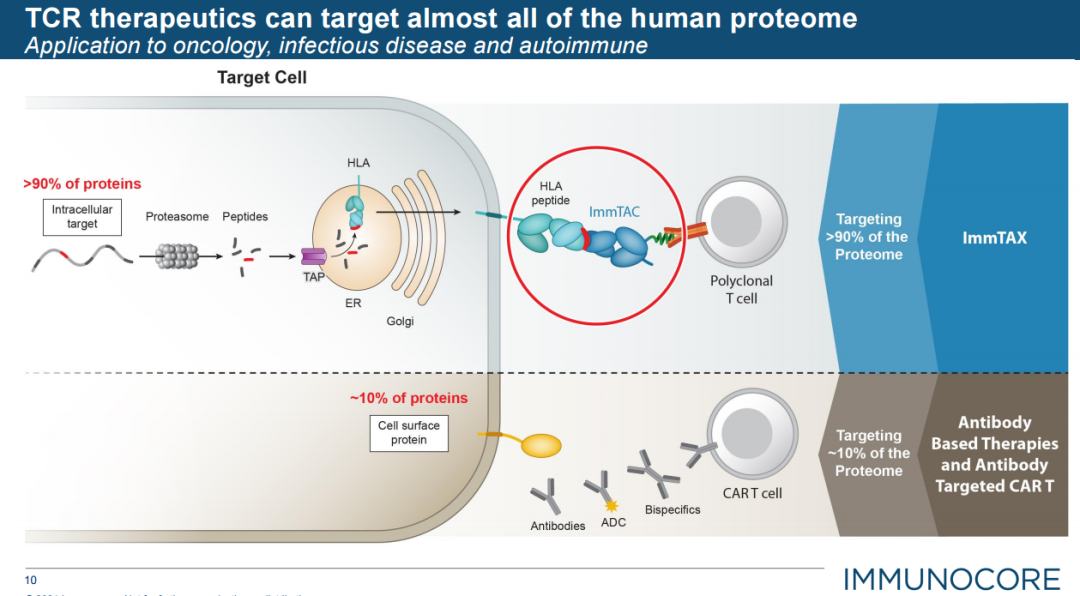
Immunocore此次获批的这款双特异性融合蛋白tebentafusp是基于其核心技术平台ImmTACs开发的首个生物制剂,该蛋白一端是由工程化改造的高亲和力T细胞受体(TCR)结合域,可以靶向肿瘤细胞表面的gp100;另一端是靶向T细胞表面CD3的单链抗体片段(scFv)组成。

TCR结构域首先识别并结合到肿瘤细胞表面peptide-HLA。然后,抗CD3抗体片段招募并重定向T细胞至肿瘤细胞周围。这样,ImmTAC就架起了癌症细胞和T细胞之间的一座桥梁,形成免疫突触, 激活T细胞并释放溶解性颗粒,导致癌症细胞死亡。
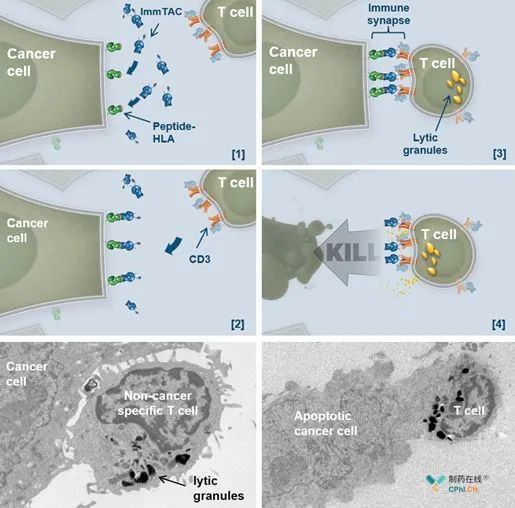 ImmTAC作用机理
ImmTAC作用机理

温馨提示
医药魔方记录行业发展,揭示产业趋势,持续输出具有行业理解和深刻洞见的内容,包括药品市场格局变化、医药行业趋势演变、政策解读、代表性公司业务分析、医药行业标杆人物专访、重磅事件解读等,帮助用户理解医药行业生态和演变,辅助行业用户决策。
星标⭐医药魔方,这样就不会错过我们的推送啦~

操作步骤见上图:1)点击标题下方“医药魔方”,2)至右上角“…”,3)设为星标



 个人中心
个人中心
 我是园区
我是园区




