您还不是认证园区!
赶快前去认证园区吧!
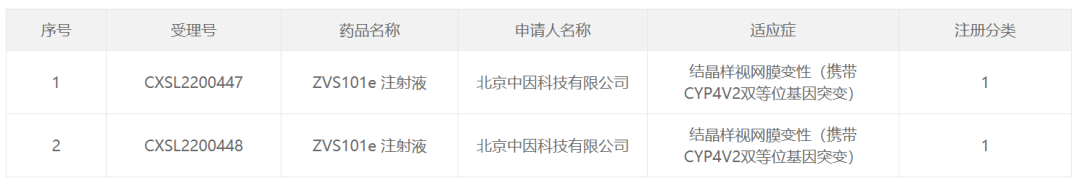 截图来源:CDE官网
截图来源:CDE官网

本文来由药明康德内容团队根据公开资料整理编辑,欢迎个人转发至朋友圈。转发授权请在「医药观澜」微信公众号留言联系我们。其他合作需求,请联系wuxi_media@wuxiapptec.com。
免责声明:药明康德内容团队专注介绍全球生物医药健康研究进展。本文仅作信息交流之目的,文中观点不代表药明康德立场,亦不代表药明康德支持或反对文中观点。本文也不是治疗方案推荐。如需获得治疗方案指导,请前往正规医院就诊。




 个人中心
个人中心
 我是园区
我是园区





