如果您喜欢CROU制药在线推送的这篇文章
欢迎点赞和转发哦~
【杭州 重庆】2022基于化学创新药案例的药物分析人员关键岗位技能提升实操演练研修班
【线上+南京】2022化工制药企业工业节能提效技术与应用实战案例培训班
【南京+线上】2022细胞治疗产品质量体系建立与GMP实施专题培训班
↑点击以上链接即可跳转培训内容界面
原标题:《浅谈口服固体仿制药制剂研发风险管理》
作者:臧萍,黄洋,钟雪彬,李纬 (南京长澳医药科技有限公司,江苏 南京)
国务院办公厅发布的《关于开展仿制药质量和疗效一致性评价的意见》,仿制药一致性评价的大幕正式拉开,这意味着今后仿制药研发的要求将越来越高,国家药审中心对仿制药审批把关也将越来越严,这无疑加大了仿制药研发和申报的难度。
纵观过去项目研发,由于参比制剂、制剂技术壁垒等问题而导致项目延期、终止、退审的现象屡见不鲜。而在仿制药一致性评价的大环境下,如再不建立有效的风险管理,将继续增加项目研发失败的风险,企业将损失更多的时间与金钱。
本文通过对制剂研发阶段的回顾,总结讨论制剂研发阶段的风险管理策略。
风险识别
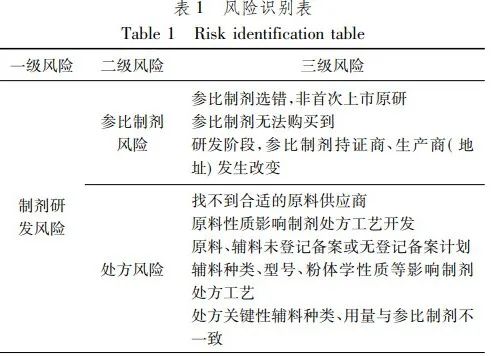
风险识别指在风险发生前,人们应用各种方法分析所面临的风险及风险产生的潜在原因,判断哪些风险会造成危害。风险识别是风险管理的第一步,也是很关键的一步,如果不能正确识别主要风险,后面的风险管理也就无从谈起。汇总制剂研发阶段风险初步识别结果如表 1。
风险分析
参比制剂风险
参比制剂是仿制药研发的目标。参比制剂是指用于仿制药质量一致性评价的对照药品,可为原研药品或国际公认的同种药物。
原研药品是指在全球市场率先上市的,拥有或曾经拥有相关专利、或获得了专利授权的原创性药品。国际公认的同种药物是指在欧盟、美国获准上市并获得参比制剂地位的仿制药。
原研药品和国际公认的同种药物通常具有完善的临床研究数据或生物等效性研究数据。已收录在《化学仿制药参比制剂目录》或在美国、日本有上市的品种,一般较容易取得明确的参比制剂信息。而在欧洲或者其他小国上市的参比制剂由于各国管理的不同、品种历史沿革原因等,一般不易明确参比制剂信息,这将提高参比制剂确定的困难。
而参比制剂如果确定错误,整个研发都付之东流。另外,一些产品即使查询到明确的原研参比制剂,但由于各种原因,可能买不到参比制剂,导致项目无法进展。
同时,一个仿制药的研发到审批一般需要3~4年,研发阶段可能出现参比制剂持证商、生产商(地址)的变更,因此从立项阶段到制剂研发的整个阶段都需要关注参比制剂的风险。
处方风险
处方由原料和相应辅料组成,若通过外购获得的原料,存在无法购买到的风险。不同厂家生产的原料晶型、晶癖、粉体学性质、杂质谱等不同,会导致采用的处方、工艺不能与参比制剂完全一致。同样的,参比制剂处方中的辅料型号、厂家在国内不易获得,替代使用的辅料也将可能引起参比制剂处方工艺的不适用,特别是关键性辅料。
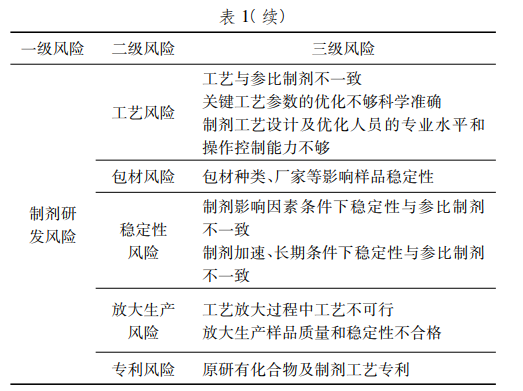
工艺风险
参比制剂的完整工艺一般无法获得,制剂人员在实验室开发的工艺可能与原研不一致,存在药学质量不一致、BE不等效的风险。另外在实验室阶段开发的工艺,其关键工艺参数的优化如不精确科学,可能引起放大生产工艺的无法交接,质量不可控的风险。而制剂工艺人员的专业水平和操作控制能力,可能影响制剂研发阶段的科学性和数据可靠性,存在核查合规风险。
包材风险
口服固体制剂内包装有铝塑泡罩包装、复合膜袋包装,铝塑泡罩包装组成有:PVC/铝、PVC/PE/PVDC/铝、PVC/PVDC/铝,复合膜袋包装组成有:聚酯/铝/聚乙烯复合膜袋、聚酯/低密度聚乙烯复合膜袋。包材主要用于阻隔光照和水分,包材材质、包装形式选择的不正确会影响样品的稳定性,存在研发失败的风险。
稳定性风险
制剂小试样品需要在影响因素条件下(高温、高湿、光照)进行样品质量评价,其外观、含量、有关物质等一般需要与参比制剂相当。影响因素结果主要用于评估样品包装材料选择的合适性,以及制剂成品在加速、长期条件下的稳定性。制剂研发的成品其影响因素结果存在与参比制剂不一致的风险。
放大生产风险
在实验室研究阶段一般采用的是小型设备,批量1~5万片,有些公司中试放大生产阶段一般采用的是大生产设备,批量放大10万~15万倍,由于设备的不同、批量的变化,放大生产存在工艺参数不适用风险,工艺无法进行的风险。同时可能引起样品质量和稳定性不合格风险。
专利风险
部分参比制剂药物厂家具有原料化合物和生产工艺专利,研发过程中可能涉及相关技术。如果未对专利内容或有效期进行深入研究,上市后很可能面临巨额经济赔偿或纠纷的风险。
风险评价
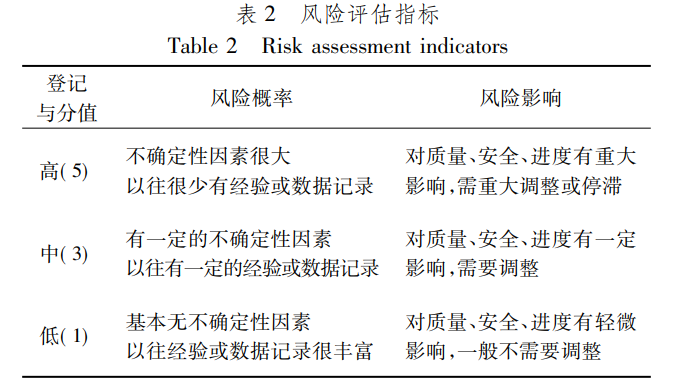
风险评估指尽力去识别风险事件的属性,并对风险发生的概率有一定预见性,同时也要评估风险带来的影响或危害。具体的评估指标如表2所示。
采用风险概率和风险影响相结合的方法进行评估,并对风险进行排序,找出对项目影响重大的关键风险点。为使评估工作能顺利进行,参考风险评估的理论,在正式评估前,建立了一个统一的、能够执行的,并且大部分人都能认可的评估指标。
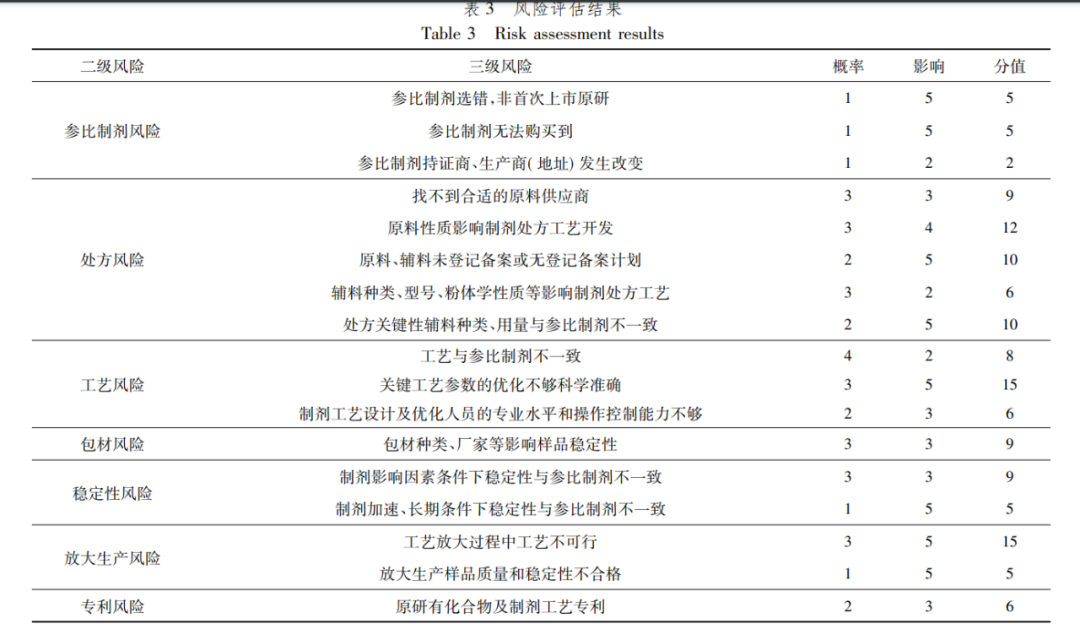
制剂部团队共有6人,分别独立对各风险进行评估和打分,去掉一个最高分和最低分,取其平均数,得到每个风险的发生概率和风险影响的分值,两者相乘,得到最终的风险值,分值越大,说明该风险因素对研发整体的影响和危害也越大。具体内容如表3所示。
风险控制
风险控制是通过各种方法和措施手段,降低或去除风险产生后可能造成的危害或损失,减少或消除风险发生的各种可能性。根据风险管理理论,主要采用风险降低、转移、回避和自留的方法控制风险。
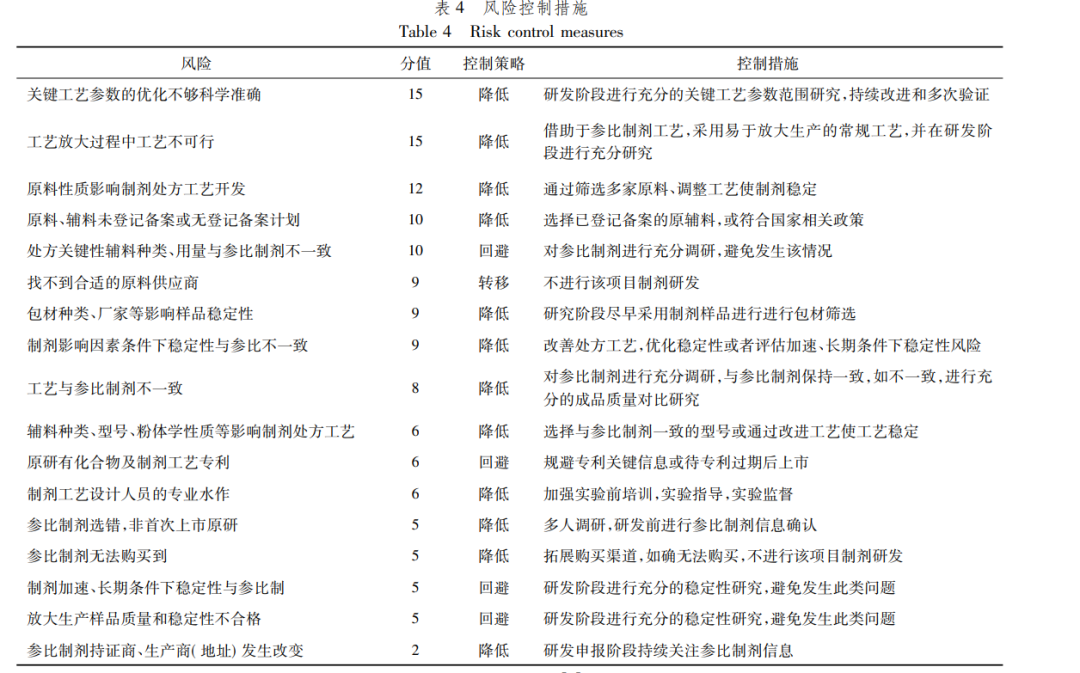
由评价结果可知,口服固体制剂研发的风险主要集中于“关键工艺参数的优化不够科学准确”、“工艺放大过程中工艺不可行”、“原辅料相关性质及登记备案情况”等方面,通过制剂人员讨论,确定如表4中的控制措施。
结语
制剂研发项目风险管理是企业管理深化的体现,应当列入项目工作计划,成为项目管理的一部分。同时制剂研发风险管理不是一次性工作,需要在研发阶段定期的、持续性的进行风险识别、风险分析、风险评估和风险控制,确保达成预期的风险控制目标,提高项目研发的成功率。
近期培训课
地点 时间 (点击↓链接阅读全文) 线上 7月21-22日 【线上】重组蛋白生物药发酵工艺开发及中试放大技术专题技术会 杭州 7月22-24日 【杭州】2022 基于化学创新药案例的药物分析人员关键岗位技能提升实操演练研修班 线上 7月23-24日 2022新药研发QbD实战培训班 线上 7月23-24日 【线上】新酶设计及酶技术应用专题培训班 线上 7月29-30日 【线上】细胞与基因治疗产品注册申报(从 IND 到 BLA)专题培训班 线上南京 7月29-31日 2022免疫细胞(CAR-T细胞)治疗产品工艺开发策略及药学研究法规解读高级研修班 线上 7月30-31日 【线上】QC实验室管理与ICH Q10 & ISO 17025体系的有机融合:理论提升与实战案例分享会 苏州 8月05-07日 【苏州】新药研发项目管理全流程解析实操班 线上南京 8月11-13日 【南京+线上】2022小核酸药的研发和CMC要点解析高级研修班 线上南京 8月12-14日 药品冻干工艺流程设计、优化、技术转移、验证及制剂处方研究研修班 重庆 8月19-21日 2022基于化学创新药案例的药物分析人员关键岗位技能提升实操演练研修班 线上 8月20-21日 【线上】以合规精益为导向的研发质量体系构建实务培训 线上南京 8月26-28日 化工制药企业工业节能提效技术与应用实战案例培训班 线上南京 8月26-28日 医药化工中试放大工艺优化、难点解析及放大安全评估专题培训班 线上 8月27-28日 【线上】2022mRNA疫苗质量分析和方法开发及表征研究专题培训会 线上南京 8月27-28日 2022细胞治疗产品质量体系建立与GMP实施专题培训班 线上 8月27-28日 【线上】ADC抗体偶联药物研发策略及质量控制专题培训班 线上 9月03-04日 【线上】临床试验监查进阶技能实战培训班 线上 9月03-04日 【线上】新药研发中药理毒理研究要点专题培训 线上南京 9月16-18日 符合欧美药品上市注册申请的技术转移及验证执行策略专题培训会

长按二维码关注我们



 个人中心
个人中心
 我是园区
我是园区