▎药明康德内容团队编辑
9月16日,2021欧洲肿瘤内科学会(ESMO)年会在线上开幕,作为欧洲最具影响力的肿瘤学会议之一,每年ESMO大会都汇集了全球生物医药和科技公司的重要研究成果。药明康德内容团队也将与读者分享ESMO大会的最新动向。本篇文章将介绍针对HER2受体的最新研究进展。

HER2受体是一个历史悠久的肿瘤学靶点,它在很多乳腺癌患者中表达,也催生了著名的HER2单克隆抗体赫赛汀(Herceptin)。除了乳腺癌,HER2受体也在胃癌等其它癌症类型中表达,近年来靶向HER2的技术不断发展,包括“改良版”的HER2单克隆抗体,靶向HER2的双特异性抗体,以及靶向HER2的多种抗体偶联药物。它们有望有效靶向HER2表达水平不高的肿瘤细胞,从而扩展可以治疗的患者范围。
改良HER2单抗组合疗法一线治疗胃癌缓解率达53%
在ESMO大会上,MacroGenics公司公布了其HER2单抗Margenza(margetuximab-cmkb)与抗PD-1抗体联用,一线治疗HER2阳性,PD-L1阳性的胃食管腺癌(GEA)患者的临床结果。
Margenza通过对抗体Fc端进行工程化改造,增强了它激发的抗体依赖性细胞介导的细胞毒性
(ADCC)。它已经获得批准治疗HER2阳性乳腺癌患者。中国的
公司已经与MacroGenics达成合作,获得这款抗体在大中华区的开发权益。
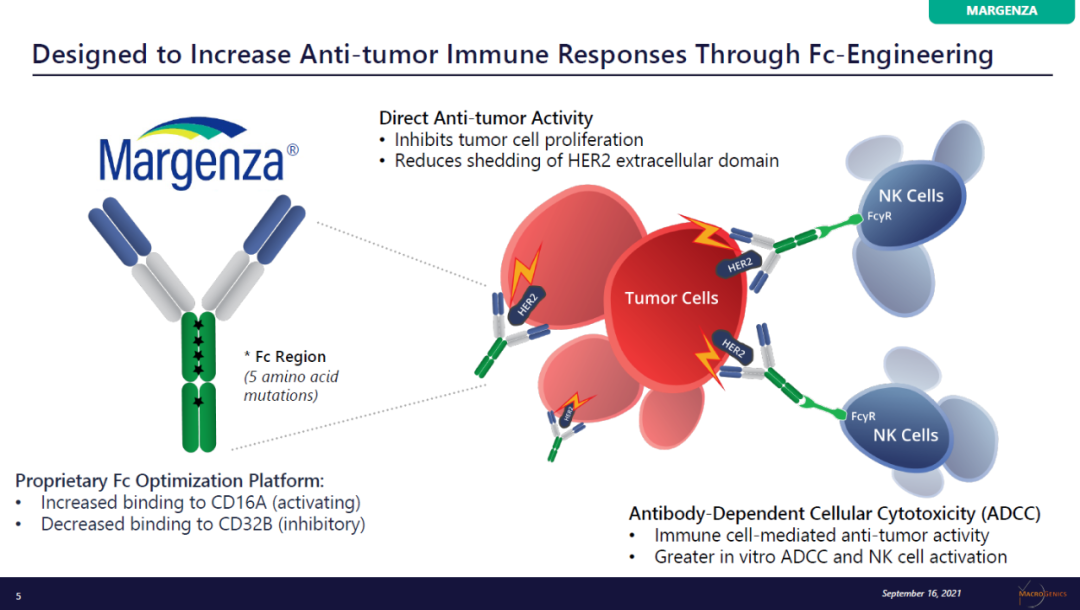
▲Margenza简介(图片来源:MacroGenics公司官网)
试验结果显示,截至2021年7月19日,在40名可以评估疗效的患者中,21名获得缓解(53%,95% CI, 36%-69%)。在接受过至少一次病灶扫描的41名患者中,32名患者的肿瘤缩小(78%)。
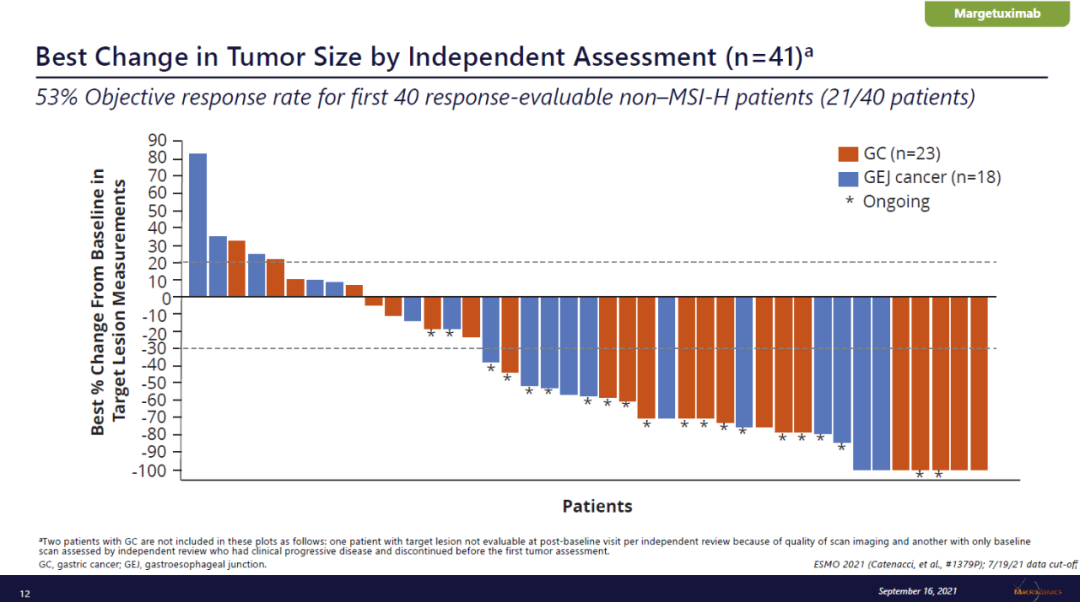
▲41名接受治疗的患者中32名肿瘤缩小(图片来源:MacroGenics公司官网)
患者的疾病控制率为73%,中位缓解持续时间为10.3个月,中位无进展生存期为6.4个月。在12和18个月时,总生存率为85%。
MacroGenics公司的新闻稿指出,试验结果显示这一没有化疗成分的组合疗法,具有成为一线治疗HER2阳性胃癌患者的潜力。
HER2双特异性抗体组合疗法一线治疗胃癌确认ORR达75%
Zymeworks开发的zanidatamab是一款靶向HER2的双特异性抗体。它通过与HER的两个非重叠表位结合,产生多种作用机制,包括双重HER2信号阻断、增加HER2蛋白从细胞表面的清除,以及提高抗体介导的细胞毒性作用,从而提高抗癌活性。
百济神州已经与Zymeworks达成研发合作协议,获得zanidatamab在亚洲(日本除外)、澳大利亚和新西兰的开发和推广的独家授权。
▲Zanidatamab具有独特的作用机制(图片来源:Zymeworks官网)
在ESMO上报告的最新结果显示,zanidatamab与化疗联用,在28名可以评估疗效的HER2阳性转移性胃食管腺癌患者中,达到75%的确认客观缓解率(ORR)和89%的疾病控制率。在28名患者中,只有1名患者的肿瘤没有缩小。
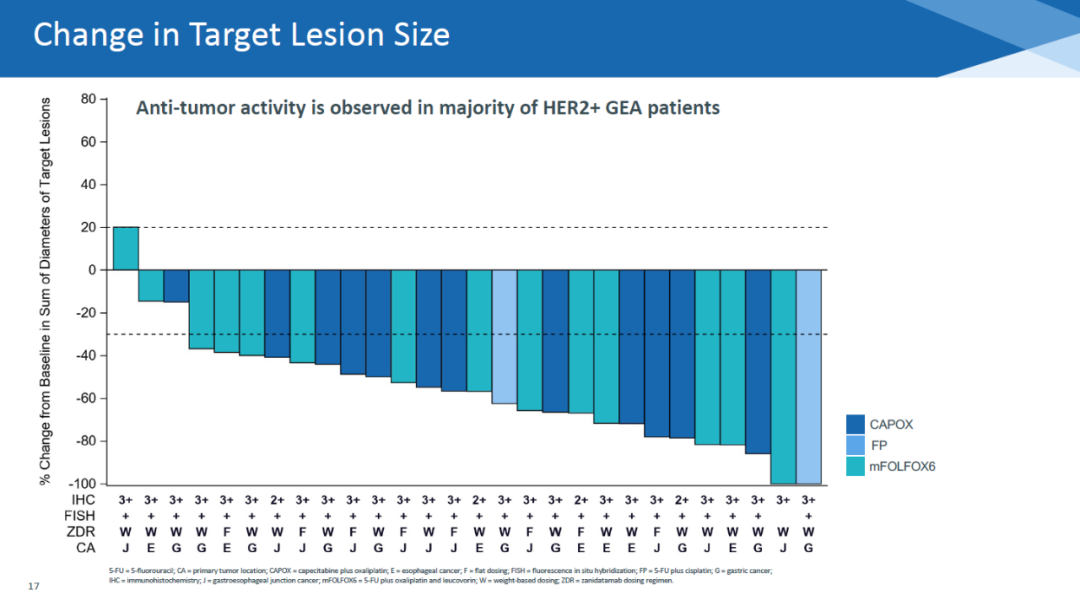
▲Zanidatamab与不同化疗联用,在28名患者中导致27名患者肿瘤缩小(图片来源:Zymeworks官网)
患者的中位缓解持续时间为16.4个月,中位无进展生存期为12.0个月。
Zymeworks预计在今年第四季度启动全球性3期临床试验。
抗体偶联药物是靶向疗法开发的一个重要方向,它将抗体的特异性与偶联药物的效力组合在一起。随着抗体偶联技术的发展,与抗体偶联的药物已经不再只是具有细胞毒性的化疗药物。例如,Acepodia的在研疗法ACE1702是一款将靶向HER2的单克隆抗体偶联在同种异体自然杀伤(NK)细胞表面,生成的抗体偶联细胞疗法。与CAR-T和TCR-T细胞疗法的不同之处在于,这一技术不需改变细胞的基因组,采用化学偶联技术让NK细胞具有靶向特定抗原的能力。

▲抗体偶联细胞技术(图片来源:Acepodia公司官网)
在ESMO大会上公布的1期临床试验中期结果显示,ACE1702在剂量递增研究中的前4个剂量均表现出良好的安全性和耐受性,没有发现剂量限制毒性,细胞因子释放综合征(CRS),免疫效应细胞相关神经毒性综合征(ICAS),或移植物抗宿主病(GvHD)。
而且,一名接受30亿细胞/疗程ACE1702治疗的患者获得部分缓解,这名患者同时显示血清中IFNγ和IL-10水平显著上升。
药明巨诺
公司在2020年与Acepodia公司
,获得ACE1702在中国大陆、香港和澳门地区的临床和商业化的专属优先授权。
Silverback Therapeutics公司开发的SBT6050是一款抗体偶联免疫刺激剂。它将激活Toll样受体8(TLR8)的激活剂偶联在靶向HER2的单克隆抗体上,旨在激活肿瘤中的髓系细胞,引发它们的抗肿瘤反应。
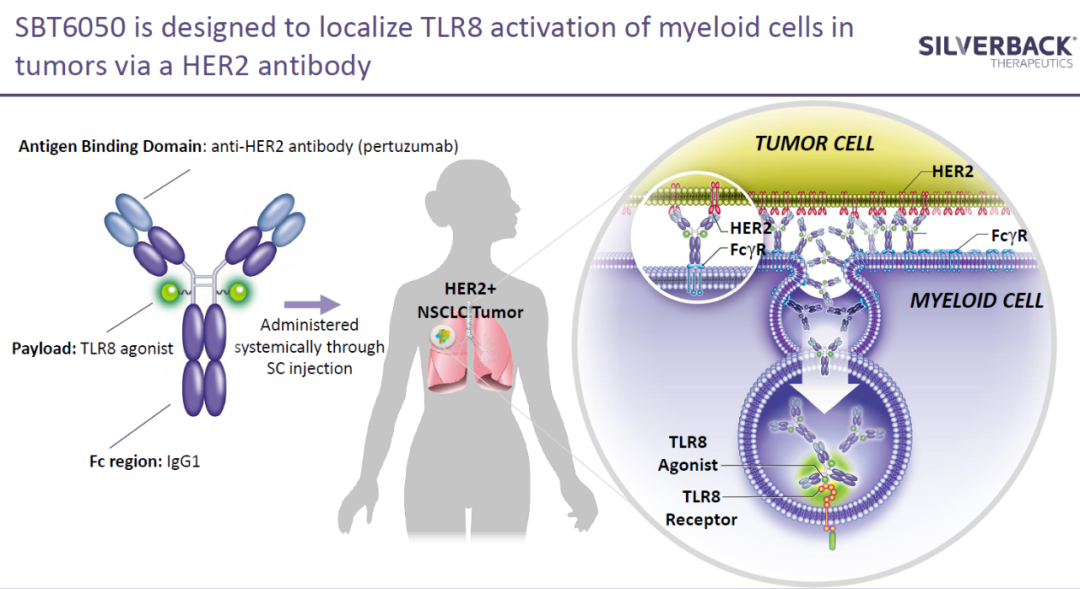
▲SBT6050简介(图片来源:Silverback Therapeutics公司官网)
该公司正在进行的1/1b期临床试验在表达HER2的多种不同肿瘤类型中检验了SBT6050单药或与Keytruda联用的安全性和疗效。
试验结果显示,SBT6050单药或与Keytruda联用表现出良好的安全性。而且,不同剂量的SBT6050均提高了与髓系细胞、T细胞和NK细胞激活相关的生物标志物水平。
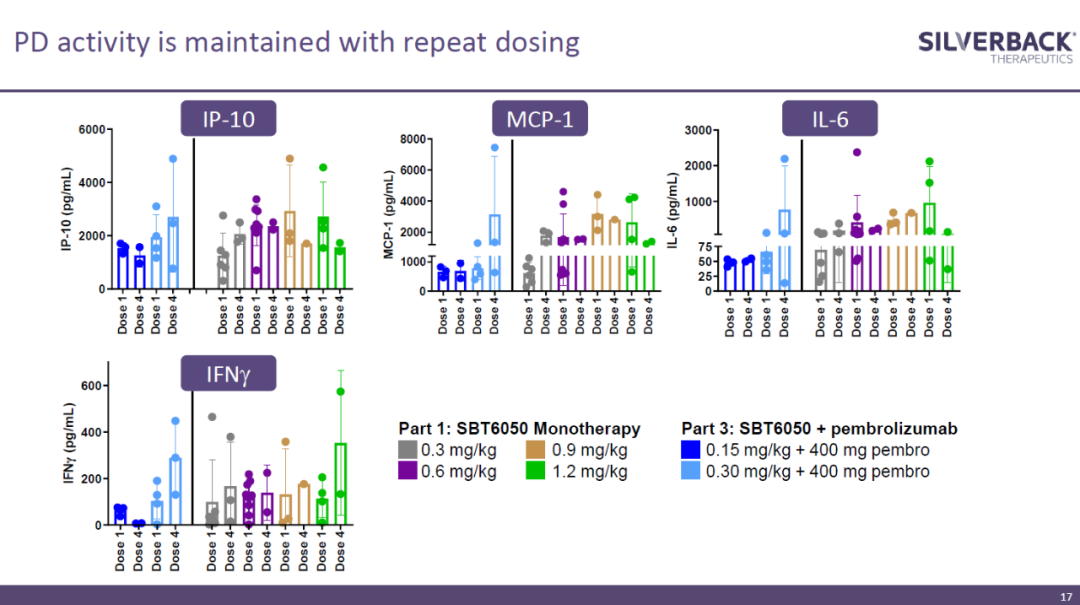
▲不同剂量的SBT6050均提高与髓系细胞、T细胞和NK细胞激活相关的生物标志物水平(图片来源:Silverback Therapeutics公司官网)
在乳腺癌、胃食管腺癌和NSCLC患者中,SBT6050表现出抗癌活性的早期迹象。该公司将继续探索SBT6050与其它HER2靶向疗法联用的效果。
ESMO大会将在9月16日到9月21日进行,药明康德内容团队将持续为您带来大会的最新动态,敬请关注。
参考资料:
[1] MacroGenics Announces Clinical Results from Cohort A Part 1 of Phase 2/3 MAHOGANY Study of Margetuximab in Combination with Retifanlimab in Gastroesophageal Adenocarcinoma at ESMO 2021Retrieved September 16, 2021, from https://www.globenewswire.com/news-release/2021/09/16/2298108/0/en/MacroGenics-Announces-Clinical-Results-from-Cohort-A-Part-1-of-Phase-2-3-MAHOGANY-Study-of-Margetuximab-in-Combination-with-Retifanlimab-in-Gastroesophageal-Adenocarcinoma-at-ESMO-.html
[2] SBT6050-101: Phase 1/1B Interim Clinical Study Update. Retrieved September 16, 2021, from https://ir.silverbacktx.com/static-files/80acc4d3-1e79-45c4-b9ca-27f7ef7884ff
[3] Acepodia Presents Positive Interim Phase 1 Feasibility Data for Antibody Cell Effector Therapy, ACE1702, in Advanced HER2-Positive Tumors. Retrieved September 16, 2021, from https://www.globenewswire.com/news-release/2021/09/16/2298101/0/en/Acepodia-Presents-Positive-Interim-Phase-1-Feasibility-Data-for-Antibody-Cell-Effector-Therapy-ACE1702-in-Advanced-HER2-Positive-Tumors.html
[4] Zanidatamab Phase 2 Clinical Trial Demonstrates Promising Response Rate And Durability In First-Line HER2-Positive Gastroesophageal Adenocarcinoma (GEA) At The European Society For Medical Oncology (ESMO) Annual Congress. Retrieved September 16, 2021, from https://ir.zymeworks.com/news-releases/news-release-details/zanidatamab-phase-2-clinical-trial-demonstrates-promising
免责声明:药明康德内容团队专注介绍全球生物医药健康研究进展。本文仅作信息交流之目的,文中观点不代表药明康德立场,亦不代表药明康德支持或反对文中观点。本文也不是治疗方案推荐。如需获得治疗方案指导,请前往正规医院就诊。
版权说明:本文来自药明康德内容团队,欢迎个人转发至朋友圈,谢绝媒体或机构未经授权以任何形式转载至其他平台。转载授权请在「药明康德」微信公众号回复“转载”,获取转载须知。













 个人中心
个人中心
 我是园区
我是园区




