
近年,非酒精性脂肪性肝炎(NASH)领域的药物开发,极为火热!由于其发病率的全球持续上升,国内外药企对其投入和开发进度都在尽可能的提速,以期早日取得实质性进展,从而分得这块已知领域的巨大蛋糕。但至今尚未有品种上市,且临床失败的声音更是络绎不绝(如前不久奥贝胆酸于 NASH 领域的失利...)。
不过,凭借该领域所储藏的巨大市场潜力诱惑,药物开发火热程度还在持续升温,进入临床开发的品种数量也在持续增多!

疾病介绍
非酒精性脂肪性肝病(NAFLD),是世界上最常见的慢性肝病,其影响近 30% 的成年人和 70-80% 的肥胖和糖尿病患者。NAFLD 涵盖了从单纯性脂肪变性到非酒精性脂肪性肝炎(NASH)的组织学范围,而 NASH 可以发展为肝硬化和终末期肝病,是美国接受肝移植的成年人中第二大主要肝病病因,并且预计未来将成为最主要的病因。此外,NASH 还是2型糖尿病、心血管疾病和终末期肾脏疾病的高危因素。
NASH 的发病机理当前尚有争议:在传统的「两次打击」学说中,肝脂肪变性是第一个「打击」,它增加了肝对第二次打击的敏感性,并认为这是造成肝损伤、炎症和纤维化的原因;而近年的研究挑战了这一观点,「多重平行命中」假说越发受到青睐,在该假说中,不同的疾病事件是并行发生而不是连续发生,以诱导肝损伤。
按照这种观点,单纯性脂肪变性和 NASH 是两种具有不同发病过程的独立适应症。因此,所有导致 NASH 发生的事件都是潜在的治疗靶点,包括胰岛素抵抗、脂毒性、氧化应激、内质网应激、线粒体功能障碍、脂肪组织功能异常、先天免疫,细胞因子分泌和免疫调节的改变等等。
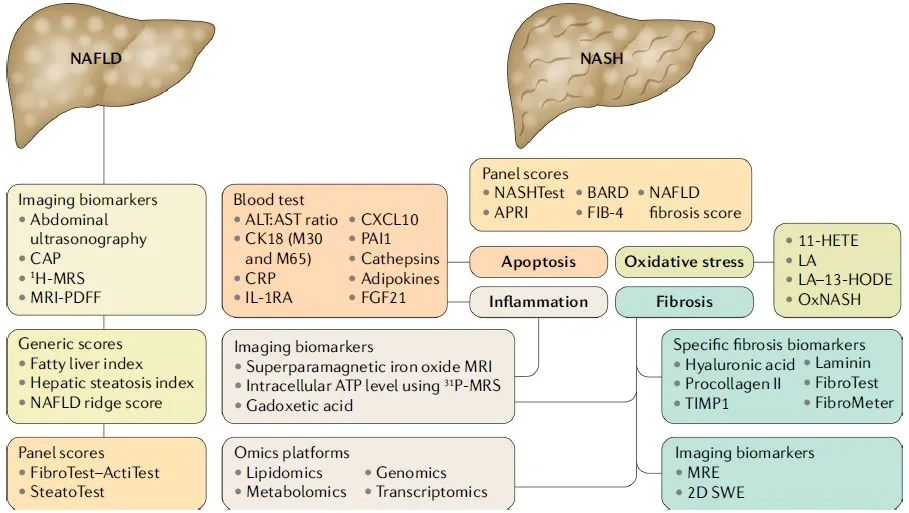
图 1.1 NAFLD 和 NASH 的非侵入性评估

NASH 全球研发高阶段药物及靶点统计
全球针对 NASH 适应症,目前已进入开发期的品种所对应的靶点有 FXR、PXR、NRF2、PPARs、GLP-1、SGLT-2、ASK-1、ACC、miR-33a、DGAT1/2、FGF21、AMPK、mTORC、CCR、AnxA1、RvD1、Galectin3、LOXL2、CYR61 等等。

图 2.1 NASH 临床试验药物靶标情况
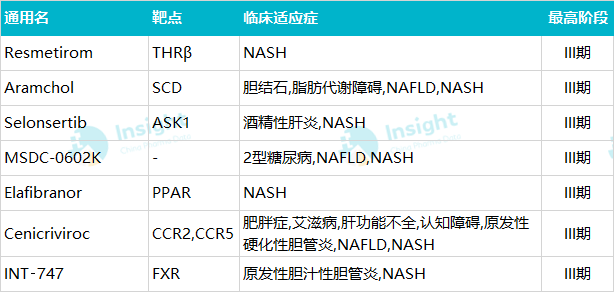
在上述研究靶点及对应开发品种的基础上,最高阶段已进入到临床 III 期的品种有 INT‑747、Resmetirom、Aramchol、Selonsertib、MSDC-0602K、Elafibranor、Cenicriviroc 等,详情见下表。
表 2.1 全球 NASH 开发阶段较高的品种
INT‑747,公司:Intercept pharma
INT‑747(奥贝胆酸),由 Intercept pharma 研发,2016 年获 FDA、EMA 批准上市,Intercept 制药公司拥有在日本和中国以外地区开发奥贝胆酸的全球权利,在中国和日本则权属日本住友;临床用于对 UDCA 反应不足的原发性胆汁性胆管炎成人患者,或作为单药疗法用于对 UDCA 不耐受的原发性胆汁性胆管炎成人患者。
在 NASH 适应症方面,2015 年 1 月被 FDA 授予突破性药物资格,并于 2015 年 9 月正式启动 III 期研究,成为全球第一个进入 III 期临床的 NASH 药物。但就在前不久,美国 FDA 拒绝了奥贝胆酸用于由 NASH 引起的纤维化的新药申请,并在回应函中表示,根据当前数据认为奥贝胆酸基于替代组织病理学试验终点的预期收益仍不确定,且收益并没有超过潜在的风险,故不支持其加速批准。
Resmetirom,公司:Madrigal
Resmetirom 最初由罗氏公司开发,2008 年 Madrigal 获得该药的全球开发权;2017 年 10 月,Madrigal 公布了 NASH 方面的临床前试验数据;2018 年 11 月,Madrigal 开展的治疗 NASH 的临床 II 期试验完成;2019 年 3 月,Madrigal 开展治疗 NASH 的临床 III 期试验启动。
Aramchol,公司:Gal Med Pharmaceuticals
Aramchol 由 Gal Med Pharmaceuticals 研发,处于临床 II/III 期,用于治疗 NASH,同时也在进行 NAFLD 与胆结石的临床 II 期研究;2014 年 Aramchol 因 NASH 获得美国快速通道资格。
Selonsertib,公司:吉利德
Selonsertib 由吉利德开发,是一种 ASK-1 抑制剂,目前处于治疗 NASH 的临床 III 期试验以及治疗严重酒精性肝炎的临床 II 期试验阶段;此外,还进行了糖尿病肾病和肺动脉高压的临床 II 期试验。
MSDC-0602K,公司:Metabolic Solutions
MSDC-0602K 由 Metabolic Solutions 开发,处于治疗 2 型糖尿病和 NASH 的临床 III 期和治疗 NAFLD 的临床 II 期;2016 年,Metabolic Solutions 创建了 Cirius Therapeutics,以推进 MSDC-0602K 的临床开发,用于治疗非酒精性脂肪肝疾病。
Elafibranor,公司:Genfit
Elafibranor 由法国 Genfit 公司开发,是一种 PPARα/δ激动剂,治疗 NASH 处于临床 III 期,以及治疗原发性胆管炎 (PBC) 和非酒精性脂肪肝的临床 II 期试验阶段,以及治疗肝病的临床 I 期阶段。2014 年 2 月,FDA 批准 elafibranor 用于治疗 NASH 的快速通道资格;2019 年 4 月,elafibranor 被美国 FDA 认证为治疗原发性胆管炎(PBC)的突破性疗法。
Cenicriviroc,公司:武田
Cenicriviroc 由武田制药研发,2007 年武田与 Tobira 达成共同研发该化合物协议,目前正在进行治疗 NASH 的临床 III 期试验,治疗认知障碍、艾滋病、非酒精性脂肪肝病和原发性硬化性胆管炎处于临床 II 期;2015 年,该化合物因治疗 NASH 获得美国快速通道资格。

国内 NASH 品种开发赛道统计
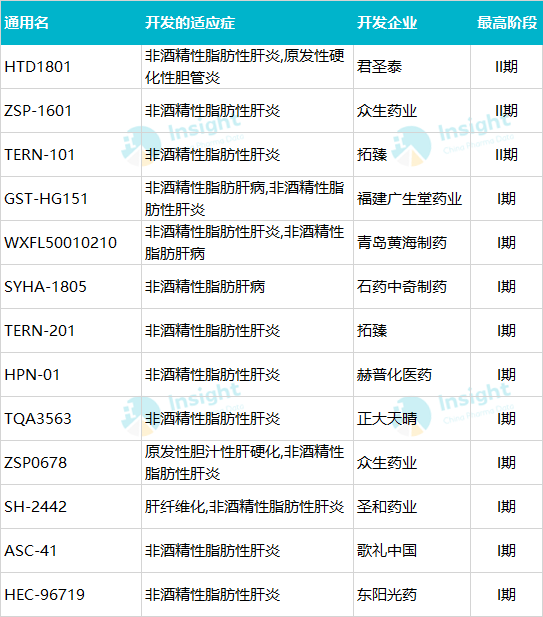
国内企业对于 NASH 适应症的药物开发,最高阶段进入到临床 II 期,相关品种有 HTD1801、ZSP-1601、TERN-101;而进入到临床 I 期的品种有十余个,大部分为国内创新型企业及上市药企;详情见下表。
表 3.1 国内 NASH 开发公司统计
众生药业
众生药业,当前是一家 A 股上市公司。研发管线主攻眼科、心脑血管、呼吸系统疾病、消化系统疾病、糖尿病、肿瘤及老年性退行性病变的预防和治疗。
公司开发的 ZSP1601 片是国内第 1 个获得临床试验批件并具有全新作用机制用于治疗 NASH 的创新药物,也是首个完成健康人药代及安全性临床试验的用于治疗 NASH 的国内创新药项目,并且是首个进入评价 NASH 患者早期药效学临床试验的国内创新药项目。
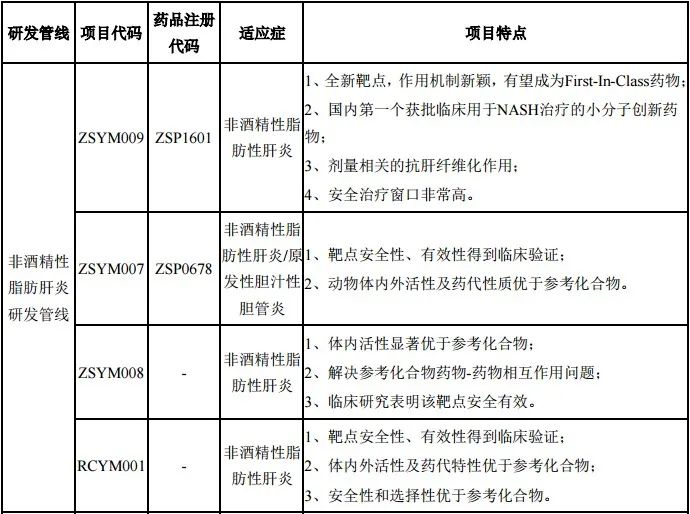
图 3.1 众生药业-NASH 品种产品线
深圳君圣泰
深圳君圣泰,专注于消化系统和代谢疾病领域,特别是 NASH 和原发性硬化性胆管炎等疾病,以满足尚未满足的临床需求。其研发的新药全球同步开发,且已有 2 个品种进入到临床 II 期,并获得美国 FDA 的快速审评通道资格认定 2 项和孤儿药认定 1 项。

图 3.1 君圣泰-重点品种产品线
拓臻
拓臻,专注于全球化肝脏疾病药物开发,主要针对 NASH、肝纤维化、肝细胞癌等慢性肝脏疾病的全新疗法。针对于 NASH,当前已有 4 款品种进入开发,分别是 FXR 激动剂 TERN-101、SSAO 抑制剂 TERN-201、THR-β激动剂 TERN-501、以及一款 GLP-1R 激动剂。
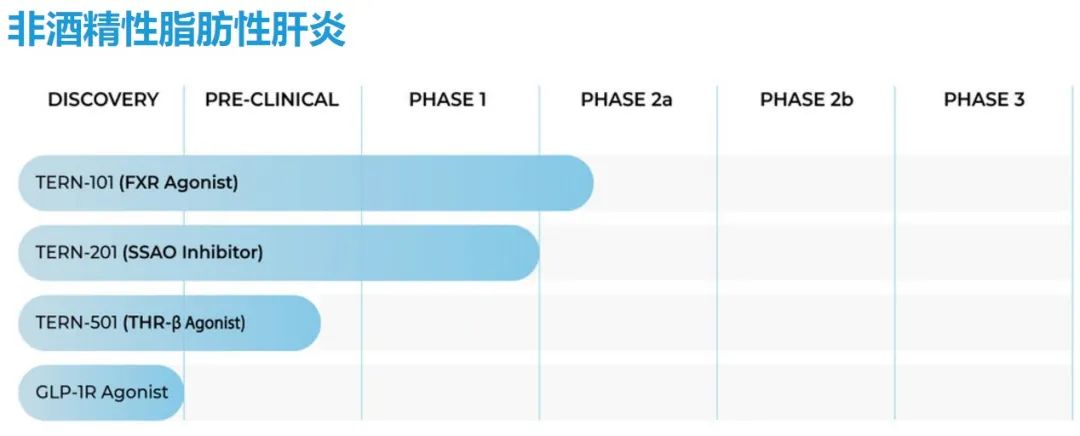
图 3.3 拓臻-NASH 产品管线

小结
NSAH,是近些年药物开发极为火热的领域之一,同时也伴随着极高的临床失败率(即使是奥贝胆酸,也尚未攻克该领域)。
不过,从全球药物开发整体状态来看,我国在该领域的跟进速度,是相当可以的。无论从开发阶段、品种类型、品种数量来比较,这一领域如若有所质的突破,那么国内新药的上市进程将被大大缩短,国内的巨大市场份额将被本国药企快速分割!且无论是对于国内的新药开发,还是患者的临床需求,都必将随着临床捷报的传来,而获利多多。
期待该领域药物的开发,能早日有所突破!
参考文献:
1. http://www.zspcl.com/index.php?m=content&c=index&a=lists&catid=15
2. https://hightidetx.com/cn/goods/product.html
3. https://www.ternspharma.com.cn/nash.html
4. NATURE REVIEWS DRUG DISCOVERY. 2016. doi:10.1038/nrd.2015.3
5. NATURE REVIEWS. https://doi.org/10.1038/s41575-018-0014-9
6. Nature Biotechnology VOL 37 MARCH 2019. https://doi.org/10.1038/s41587-019-0047-9
7. Nature Medicine. VOL 908 24. JULY 2018 .908–922.
8. 美国 FDA 官网
9. 各大公司官网及公开年报信息

活动预告




 个人中心
个人中心
 我是园区
我是园区




