
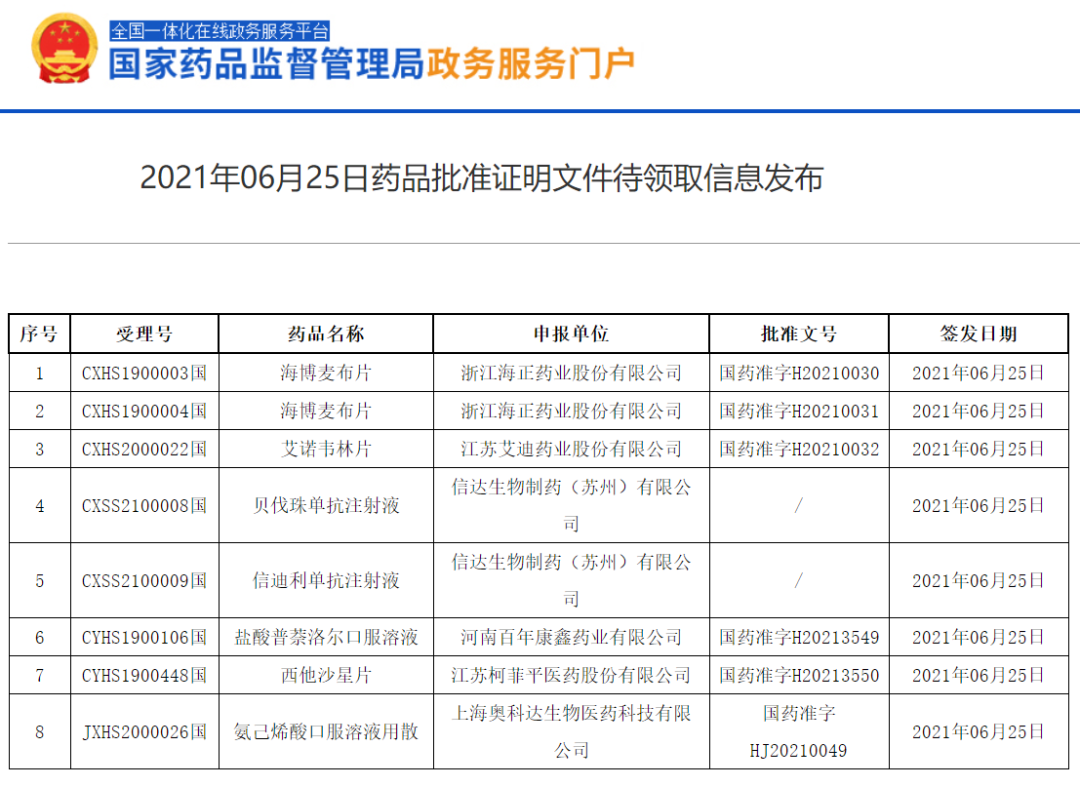
6月25日,国家药监局官网显示,信达生物信迪利单抗新适应症上市申请(CXSS2100009)获批,与贝伐珠单抗(达攸同)联合用于既往未接受过系统治疗的不可切除或转移性肝细胞癌。这是信迪利单抗在非霍奇金淋巴瘤、非鳞状NSCLC、鳞状NSCLC之后获批的第4项适应症。
该项适应症上市申请资料递交是基于一项代号为ORIENT-32的随机、开放、多中心II/III期研究,旨在评估信迪利单抗(程序性死亡1[PD-1]抑制剂)联合贝伐珠单抗(IBI305)对比索拉非尼用于一线治疗不可切除HBV相关的肝细胞癌。
本研究分成2个部分,第1部分是II期单臂安全导入期,患者接受信迪利单抗(200 mg,每3周1次)联合贝伐珠单抗(15 mg/kg,每3周1次)静脉给药。第2部分是III期随机对照研究,符合条件的患者随机(2:1)接受信迪利单抗(200mg,每3周1次)联合IBI305(15mg/kg,每3周1次)静脉给药;或口服索拉非尼(400mg,每日两次),直至出现疾病进展或不可接受的毒性。采用随机分组,并按大血管浸润和/或肝外转移(是vs否)、基线甲胎蛋白(AFP)水平(<400 vs≥400 ng/mL)和ECOG体能状态(0 vs 1)进行分层。III期的主要终点为总生存期和独立影像学审查委员会(IRRC)根据RECIST 1.1标准评估的、在意向性治疗(ITT)人群中的无进展生存期。
从2019年2月11日至2020年1月15日,本研究共入组595例患者,其中,II期共24例患者入组且接受治疗,III期共571例患者随机分配至信迪利单抗-贝伐珠单抗组(n=380)或索拉菲尼组(n=191)。
在II期研究中22例(92%)发生与任一研究药物相关的不良事件,其中3-4级发生率为29%,与任一研究药物有关的严重不良事件发生率为6例(25%),未发生导致死亡的不良事件。根据II期部分的初步安全性和疗效数据,经安全性评估委员讨论后开始III期研究。
截至数据截止日期(2020年8月15日),信迪利单抗-贝伐珠单抗生物类似药组的中位随访时间为10.0个月(IQR 8.5-11.7),索拉非尼组为10.0个月(IQR 8.4-11.7);与索拉非尼组相比,独立影像学审评委员会(IRRC)评估的信迪利单抗-贝伐珠单抗生物类似药组的无进展生存期也显著改善(中位值4.6个月[95%CI 4.1-5.7] vs.2.8个月[95%CI 2.7-3.2],分层HR 0.56[95%CI 0.46-0.70],p<0.0001)。

图A:独立影像基于RECIST V1.1评估的PFS Kaplan–Meier曲线图
在总生存期的首次期中分析中,与索拉非尼相比,信迪利单抗-贝伐珠单抗生物类似药的总生存期也显著改善(中位值未达[95%CI 未达–未达] vs 10.4个月[94%CI 8.5-未达],HR 0.57 [95%CI 0.43-0.75],p<0.0001)。

图B: ITT人群Kaplan–Meier生存曲线图
最常见的3-4级治疗期间的不良事件为高血压(信迪利单抗-贝伐珠单抗生物类似药组380例患者中55例[14%]vs索拉非尼组191例患者中11例[6%])和掌跖红肿疼痛综合征(无vs 22例[12%])。信迪利单抗-贝伐珠单抗生物类似药组123例(32%)患者和索拉非尼组36例(19%)患者发生严重不良事件,两组与任一研究药物相关的导致死亡的不良事件发生率分别为6例(2%)和2例(1%)。
肝癌是全世界范围内常见的消化系统恶性肿瘤,中国的肝癌患者占全球数量的一半左右,肝癌严重地威胁着我国人民的生命和健康。肝癌的病理类型主要是肝细胞癌(hepatocellular carcinoma,HCC),占85%~90%;还有少数为肝内胆管癌(intrahepatic cholangiocarcinoma,ICC)和HCC-ICC 混合型等。在我国,HCC主要由乙型肝炎病毒(hepatitis B virus,HBV)和/或丙型肝炎病毒(hepatitis C virus,HCV)感染引起。

点亮“在看”,好文相伴



 个人中心
个人中心
 我是园区
我是园区




