▎药明康德内容团队报道
5月27日,中国国家药监局药品审评中心(CDE)公示显示,璎黎药业新一代PI3Kδ抑制剂林普利司片的新药上市申请已被纳入拟优先审评名单,适用于既往接受过二线或二线以上全身系统治疗的复发或难治滤泡性淋巴瘤患者的治疗。2021年2月,恒瑞医药已与璎黎药业达成合作,获得了该药在大中华地区的联合开发权益以及排他性独家商业化权益。

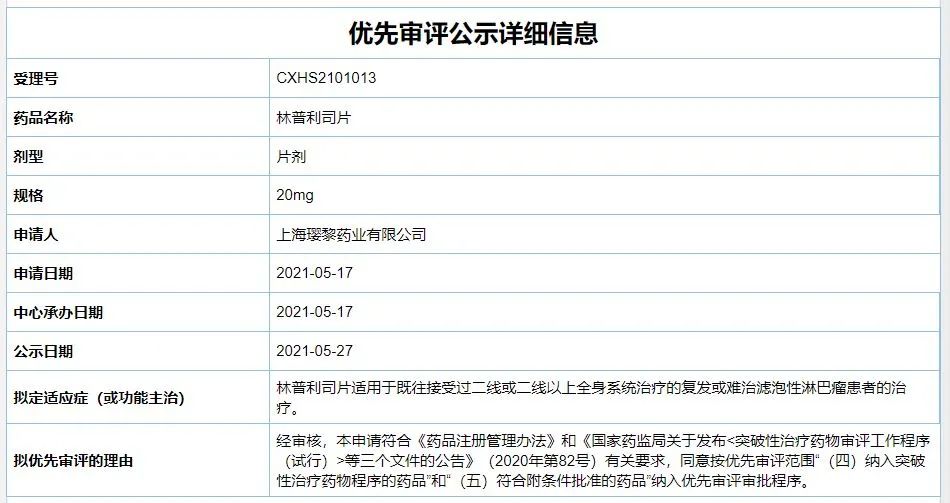
截图来源:CDE官网
林普利司(linperlisib,YY-20394)是璎黎药业自主研发的一款新一代PI3Kδ(磷酯酰肌醇3-激酶亚型δ)高选择性抑制剂。临床前研究显示,林普利司可通过抑制PI3Kδ蛋白的表达,降低AKT蛋白磷酸化水平,从而诱导细胞凋亡,抑制恶性B细胞及原发肿瘤细胞细胞系的增殖。
目前,林普利司已在中国和美国开展了多项临床试验,并显示出了显著的疗效和良好的安全性。在中国,林普利司治疗复发和/或难治滤泡性淋巴瘤的申请已于2020年9月被CDE纳入突破性治疗品种。
5月14日,璎黎药业宣布,林普利司片的新药上市申请已获CDE受理,拟用于治疗复发/难治滤泡性淋巴瘤患者。值得一提的是,这也是璎黎药业创立以来递交的首个新药上市申请。本次拟纳入优先审评意味着,该药有望加速在中国获批。
在一项2期注册临床试验中,林普利司治疗复发/难治滤泡性淋巴瘤患者表现出了显著疗效:在89例可评估的患者中,林普利司达到了80%以上的客观缓解率(ORR),以及95%以上的疾病控制率(DCR)。此外,林普利司口服给药安全可控、耐受性好。而且患者每天只需口服一次,使用方便。
根据璎黎药业早前发布的新闻稿,中国境内尚未有获批上市的PI3Kδ抑制剂,璎黎药业的林普利司片有望成为首款获批的PI3Kδ抑制剂。
值得一提的是,璎黎药业也在美国对林普利司进行开发。2018年10月,林普利司片获得FDA颁发的两项孤儿药资格,分别针对滤泡淋巴瘤和慢性淋巴细胞白血病适应症。2020年4月,林普利司片获FDA批准在美国开展2期临床试验。
期待这款创新PI3Kδ抑制剂早日在中国获批,为广大患者带来治疗选择。
相关阅读:
注:本文旨在介绍医药健康研究进展,不是治疗方案推荐。如需获得治疗方案指导,请前往正规医院就诊。
参考资料:
[1]中国国家药监局. Retrieved May 27,2021, from http://www.cde.org.cn/news.do?method=changePage&pageName=service&frameStr=20
[2]璎黎药业林普利司片上市申请获国家药品监督管理局受理..Retrieved May 14 2021, from https://mp.weixin.qq.com/s/xRvT5A7IXHcIE1F1F5Rh5g
[3]
上海璎黎药业PI3Kδ抑制剂Linperlisib治疗复发/难治滤泡性淋巴瘤2期注册临床结果喜人 .Retrieved Mar 29 2021, from https://mp.weixin.qq.com/s/6wSAcFWAB9HogX6X60L9ow
版权说明:本文来自药明康德内容团队,欢迎个人转发至朋友圈,谢绝媒体或机构未经授权以任何形式转载至其他平台。转载授权请在「医药观澜」微信公众号留言联系我们。





 药选址
药选址


