发生在基因启动子区的转录起始过程是基因表达调控的核心,决定着细胞的命运,影响众多生理病理过程。以RNA聚合酶II
(Pol II)
为核心的转录前起始复合物
(preinitiation complex,
PIC
)
,识别几乎所有编码基因和大部分非编码基因的启动子区,响应各种转录调控信号,起始基因转录。在今年4月初,复旦大学生物医学研究院/附属肿瘤医院徐彦辉团队在Science杂志报道了包含TFIID的PIC复合物结构,揭示了启动子识别及PIC装配的动态过程,该工作一经发表就得到了国内外广大同行的高度认可(专家点评Science丨新突破!徐彦辉团队全面揭示转录起始复合物的工作机制)。
在上世纪90年代,科学家们发现一个功能非常重要的转录共激活因子,命名为中介体
(
Mediator
)(BioArt按:有关中介体的具体介绍详见此前王纲教授课题组撰写的相关文章:致敬Robert Roeder & 纪念真核生物RNA聚合酶发现50周年——转录调控研究简史)
。顾名思义,Mediator可以将不同信号通路的转录激活信号,传递到PIC上激活转录。人体中绝大多数活跃基因都需要Mediator才能够实现高表达。体外实验表明,Mediator结合PIC和众多转录因子,促进启动子区PIC复合物的组装并激活TFIIH上的CDK7激酶活性,促进Pol II羧基端结构域
(Pol II CTD)
的磷酸化,极大地提升PIC的转录活性。Mediator由26个蛋白所组成,分子量1.5兆道尔顿
(MDa)
。对Mediator及PIC-Mediator复合物的研究是转录领域的核心。
最近的两项研究报道了基于TBP的PIC结合Mediator的复合物结构(Science | 何源等解析人源中介体复合物结合转录前起始复合物电镜结构 )
【1,2】
,揭示了PIC与Mediator两个复合物之间的相互作用关系。目前,对PIC和Mediator复合物的结构研究全部是基于TBP体系。
然而,几乎所有的基因转录过程都需要完整TFIID复合物,其功能并不能够被TBP所替代
。
因此,Mediator与TFIID两大核心调控因子如何协同作用促进PIC-Mediator在启动子上组装,如何调控Pol II CTD的磷酸化,如何激活转录,都是不清楚的。
基于TFIID的完整PIC与Mediator组成转录起始超级复合物
(称为
PIC-Mediator
)
,具备转录起始过程所有因子和完整的基本转录活性
(basal transcription)
。几乎所有转录因子及转录调控因子都是通过作用在PIC-Mediator复合物上激活转录起始
(activated transcription)
。PIC-Mediator复合物包含76个蛋白多肽链,分子量达4.1MDa, 具有高度的复杂性和动态性,对其进行结构解析和功能阐释是分子生物学领域几十年来的难题和期待。
2021年5月6日,复旦大学徐彦辉课题组在Science杂志上在线发表了研究长文
(Research Article)
“Structures of the human Mediator and Mediator-bound preinitiation complex”
(《人源中介体复合物及其结合转录前起始复合物的结构研究》)
。
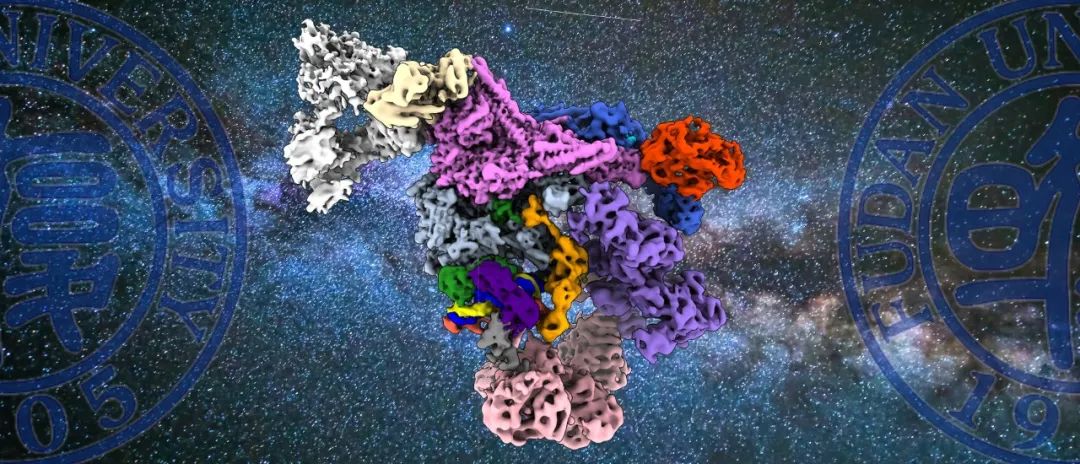
与以往基于TBP的结构相比,该项研究报道了首个结构与功能完整的PIC-Mediator复合物
(图1)
。结构分析揭示了PIC-Mediator的动态组装过程以及Mediator调控Pol II CTD磷酸化的分子机制。该项工作与徐彦辉团队近期关于PIC的研究相呼应
(专家点评Science丨新突破!徐彦辉团队全面揭示转录起始复合物的工作机制)
,较为全面的回答了转录起始过程的若干重要科学问题,是分子生物学领域的重大突破性成果。
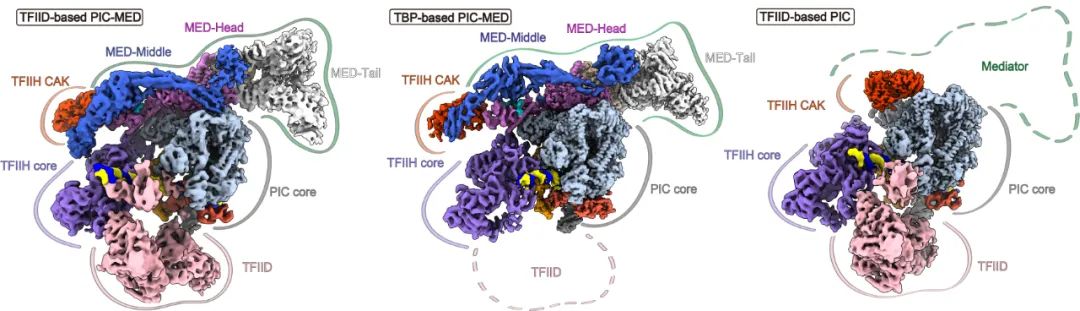
图1: 本项研究基于TFIID的PIC-Mediator复合物,为完整转录起始复合物PIC-Mediator(左),中间为何源组近期发表的基于TBP的PIC-Mediator【1】,右侧为徐彦辉组近期发表的基于TFIID的PIC
【3】
。
该项工作首先报道了人源Mediator复合物近原子分辨率的冷冻电镜结构,首次把26个Mediator亚基进行完全定位和建模,为后续结构功能研究奠定了坚实基础。研究发现Mediator的Tail模块可呈现延展构象
(
E
xtended)
和弯折构象
(
B
ent)
,两个构象的Mediator被分别命名为MED-E和MED-B。其中,MED-E与以往报道的结构相似,而MED-B构象是首次发现,表明Mediator本身的动态性。
Pol II CTD的磷酸化使得PIC与Mediator解离,允许转录复合物离开启动子进入延伸阶段。
该研究分析发现结合PIC时Mediator发生模块重排
(modular reorganization)
,通过两个相连的分子杠杆
(图2)
产生头部内夹
(Head-tilting)
和中部下倾
(Middle-down)
的构象变化
(视频)
。头部的HB1亚模块和Knob亚模块夹住Pol II CTD的两段多肽链,形成“三明治”结构,稳定Pol II CTD并将其送至CDK7活性中心进行磷酸化反应,作者提出了一种“CTD磷酸化门控”模型
(图3)
,使CTD结合在Mediator上,保证有效且持续地被磷酸化,而完全磷酸化后又使PIC与Mediator解离,允许转录机器离开启动子进入延伸阶段。值得一提的是,对Pol II CTD去磷酸化的研究中,徐彦辉和陈飞合作发现新型转录调控复合物INTAC可去除Pol II CTD磷酸化并抑制转录(专家点评Science | 徐彦辉/陈飞合作发现新的转录调控复合物INTAC并揭示其结构和功能,更新对磷酸酶PP2A的认知)。
图2: Mediator组装形成PIC-Mediator复合物的“双杆杠系统”模式图。
彩色展示组装形成PIC-Mediator复合物中的Mediator分子,灰色展示Mediator单体。黄色点表示“双杠杆系统”中的两个支点。
图3:“CTD磷酸化的门控”模型。
Mediator的头部(HB1)和中部(Knob)的两个亚模块夹住Pol II CTD的两段多肽链形成“三明治”结构,该结构使得裸露在CDK7附近的CTD(eCTD)被磷酸化,同时Head 和Middle的动态结合形成“CTD磷酸化门控”系统,部分开放的“门”使得内部的CTD(cCTD)能够被释放出来,保证CTD有效且持续性地被CDK7激酶所磷酸化。而完全磷酸化的CTD无法结合Mediator,使PIC-Mediator复合物解离进入转录延伸。
TFIID赋予了PIC-Mediator结构和功能的完整性。
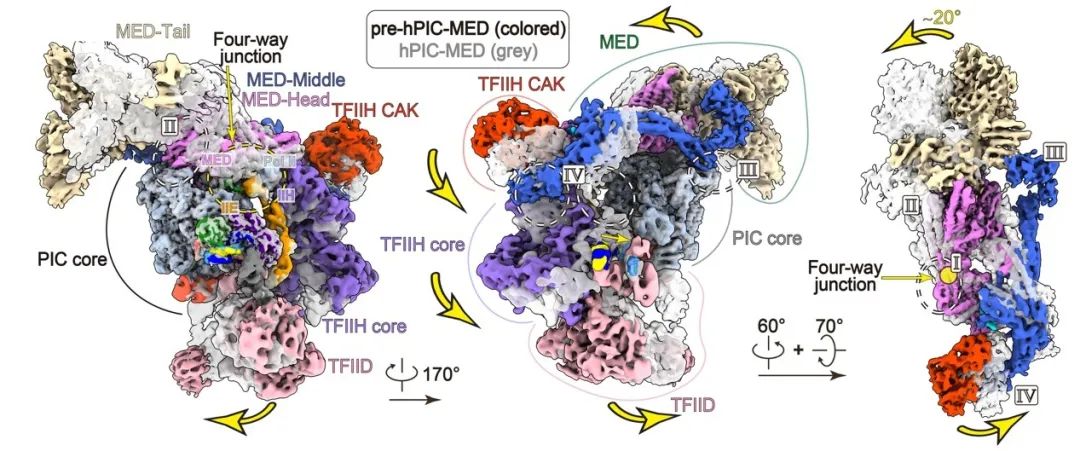
在PIC-Mediator整体结构中,Mediator和TFIID分别位于TFIIH的上下两面,两者共同结合并稳定TFIIH,使TFIIH中CDK7激酶和XPB移位酶在PIC-Mediator中正确定位并发挥活性。其中XPB推动启动子DNA进入Pol II催化中心开始转录,而CDK7磷酸化Pol II的CTD允许Pol II聚合酶离开启动子区进入转录延伸,二者的活性是转录起始所必须的。TFIID还赋予了PIC-Mediator组装的高度动态性。通过两种代表结构进行比对,可看出PIC-Mediator各个部分都不同程度的发生了模块重排
(图4,视频)
,使其更好地适应高度动态的转录起始过程。
上述发现在基于TBP的PIC-Mediator系统中并未被报道,说明TFIID在转录起始超级复合物PIC-Mediator的组装和发挥功能中的关键作用。
图4:PIC-Mediator复合物的动态组装。
两种PIC-Mediator复合物的结构比对,彩色展示PIC-Mediator初态(pre-hPIC-MED),灰色展示PIC-Mediator终态(hPIC-MED)。
该项工作提供了具有生理相关性和功能完整性的PIC-Mediator复合物结构,揭示了完整PIC-Mediator复合物的动态组装过程,提出了Mediator调控Pol II CTD磷酸化可能的分子机制。结构及其所提示的功能关联性对后续转录机制研究具有重要的指导意义,将分子生物学领域相关研究推到了一个新的高度。
复旦大学附属肿瘤医院助理研究员陈曦子
(复旦大学生物医学研究院2019届博士毕业生)
、阴晓彤
(复旦大学生命科学院2018届博士毕业生)
,复旦大学生物医学研究院2016级博士生李佳蓓、2016级博士生武子涵、2017级博士生戚轶伦、2017级博士生王鑫鑫为本文共同第一作者,徐彦辉教授为通讯作者。
https://science.sciencemag.org/content/early/2021/05/05/science.abg0635.full
王纲 教授
(复旦大学生命科学学院,Mediator与转录调控研究专家)
近年来,凭借冷冻电镜技术,具有25-30个亚基的Mediator复合物的结构被不断解析出来,物种来源包括酵母、小鼠和人,大有百舸争流之势。徐彦辉教授的这项研究首次解析了完整的人源PIC-Mediator复合物(Mediator-bound preinitiation complex),展示了PIC-Mediator的动态组装,并提出Mediator调控Pol II CTD磷酸化的分子模型。彦辉实验室这些年一系列的漂亮工作,让他们跻身于表观遗传及转录调控的结构生物学领域最前沿,与欧美最顶尖的实验室(如Roger Kornberg, Patrick Cramer等)比肩而行。我们在此表示热烈祝贺!
这项工作为大家带来了丰富的基因转录调控新知识,还引起了我们对以往相关研究的重新审视与思考,在这里初步列举几点以供参考。
1、首先在方法上,该研究发现删除MED1的无序结构IDR之后,Mediator Complex的结构均一性会更佳,论文中针对这一问题,做了严谨的对照,在体外的 体系中,转录活性和复合物构象等都与全长MED1产生的Mediator一致,提示MED1 的IDR删除并不影响Mediator的体外构象和功能。MED1是Mediator中分子量排行第三位的亚基,约180kDa。洛克菲勒大学的Robert Roeder教授发现了MED1一系列相互作用蛋白(包括核受体TR、VR和ER),并一直致力于发掘更多的MED1相互作用蛋白,他的这些研究表明MED1通过与多种不同转录因子互作,接受外界信号以改变Mediator的构象,进一步地改变特定基因的转录活性。近年来有研究指出MED1 的IDR区域结合转录因子引起液液相分离,导致转录机器的聚集并调控转录。结合该项工作中展示的Mediator本身的结构动态性,使转录因子,Mediator,转录机器之间的相互作用比预想的还要复杂,也是值得深入研究的一个方向。
2、该工作观察到Mediator有弯曲(bent)和延展(extended)两种精细结构。Mediator构象的动态性是这个领域几十年来一直关注的问题。在冷冻电镜充分发展起来前,科学家通过低分辨率的电子显微镜技术观察到Mediator具有多种状态,在结合转录因子,Pol II等不同情况下,还有进一步的构象改变。一个假设的模型是,Mediator的多种状态类似于弹簧机的工作原理,有利于Mediator与Pol II的快速动态结合和分离,从而快速响应转录因子的信号,反复启始基因转录。但低分辨结构无法提供明确的分子机制,该项工作通过比较Mediator结构和PIC-Mediator的高分辨结构,展示了双杠杆的模型,很好的解释了Mediator在结合PIC过程中产生构象变化以及CTD结合Mediator的分子机制。我们见证了冷冻电镜技术的强大能力,也更加期待未来有更多更精细关于Mediator-PIC动态结构的发现。
3、 文章展示了四种PIC-Mediator构象并详细讨论了其中两种高分辨的结构。回到真实细胞内,PIC-MED的结构可能更加多样化。PIC-Mediator在不同细胞类型中、不同基因启动子上、结合不同转录因子时,其构象乃至组份都有可能大相径庭,具有所谓的特异性(specificity)。我们相信从这项工作所解析的两种结构模型出发,PIC-Mediator的结构还有更多值得发掘的精彩。
4、文章还确立了Mediator参与到CTD磷酸化的调控,并提出了可能的分子机制模型。我们知道Mediator不止于调控转录起始,它还参与到转录延伸、可变剪接、染色质修饰和远端增强子活性等调控过程(而CTD磷酸化也参与这些过程);近年来,Mediator与相分离的相关工作又将其推上研究热点。文章中关于Mediator的结构及交联质谱数据为本领域的科学家提供重要的resource,有利于研究Mediator的其他非经典功能,包括转录后的表观遗传学调控以及染色质高级结构调控等。
陈飞 研究员
(复旦大学生物医学研究院,基因转录调控研究专家)
基于TFIID的PIC- Mediator复合物——转录起始的最完整拼图
真核生物中,基因表达的精密调控,既依赖于有组织特异性的转录因子作为特定基因表达网络的“指挥官”,又依赖于一套通用的机器
(俗称“转录机器”)
完成“指挥官”指定的基因转录过程并产生相应的转录产物
(mRNA)
。简单来说,不同的转录因子通过同一套转录机器,实现了基因表达的细胞和组织特异性。而Mediator复合物,正是转录因子和转录机器之间“信息传递”的主要桥梁。
自上世纪90年代由Richard Young、Roger Kornberg和Robert Roeder 通过遗传和生化手段独立发现这样一个介导转录激活的复合物后,Mediator就一直站在转录调控领域舞台的中央。随着转录调控高通量技术和结构生物学的进步以及研究的深入,人们对它的理解也不断被修正和加深。目前领域的主流观点认为是Mediator几乎介导了所有蛋白编码基因的转录起始和正常激活。然而,对Mediator调控转录的理解,却面临着两个核心难题:1、Mediator如何调控转录起始复合物(PIC)的组装和激活?2、Mediator如何传递转录因子对基因表达的激活?
在PIC组装过程中,TFIID作为最关键的因子,主导了整个动态装配的过程。TFIID包含了识别TATA box
(约15%的基因启动子还有TATA box)
的TBP和13个TBP结合蛋白
(TAF1-13)
。众多研究表明,虽然TBP在转录起始过程中有核心作用,但在生理条件下它并不能取代TFIID的功能,今年4月初徐彦辉团队发表在Science上的工作从结构的角度给出了答案。该工作发现TFIID不仅能通过TBP识别TATA box,还可以通过TAFs识别下游的启动子元件,从而实现对几乎所有蛋白编码基因的调控。该工作刷新了人们对PIC组装和TFIID功能的认识,修正了之前分子生物学教科书的一些结论,也为新的研究提出了方向。其中一个核心问题就是,对基于TFIID的PIC,转录共激活因子Mediator 是如何协调其组装和激活的。
徐彦辉团队今天在Science上发表的这项工作,正是回答了上述关键问题。该工作揭示了PIC-Mediator的动态组装过程、TFIID在其中发挥的重要功能、以及Mediator如何通过构象变化促进CDK7对Pol II的C端重复序列(CTD)的特定位点的磷酸化。需要强调是,Pol II CTD的不同位点的磷酸化对转录有重要的协调作用。比如,CTD的第5位丝氨酸的磷酸化
(简称pSer5)
主要促进转录起始,而第二位丝氨酸的磷酸化
(简称pSer2)
主要与转录延伸和终止相关。该工作提出了“CTD磷酸化门控(CTD gating)”模型,揭示了
Mediator诱导CTD重复片段的高度磷酸化的机制
,为揭示Mediator激活转录起始提供了最直观的分子机制。而基于TFIID的PIC-Mediator结构,也是
迄今最完整、最接近生理条件下的转录起始复合物的结构。
值得一提的是,正因为Pol II CTD的磷酸化在转录中的重要功能,它受到了一系列激酶和磷酸酶的紧密调控。比如徐彦辉团队和我们合作发现新型转录调控复合物INTAC,可去除Pol II CTD多个位点的磷酸化。而在转录起始过程中,尤其在生理条件下,Pol II CTD的激酶和磷酸酶,以及它们的调控因子
(比如Mediator)
如何协同调控转录起始的效率,将是未来研究的一个重要方向。
徐彦辉团队的这项研究回答了“Mediator如何调控转录起始复合物(PIC)的组装和激活”这个转录领域的核心问题。但“Mediator如何传递转录因子对基因表达的激活?”这个难题仍有待新的研究和发现来揭示。让我们拭目以待!
1、Abdella, R., Talyzina, A., Chen, S., Inouye, C. J., Tjian, R., & He, Y. (2021). Structure of the human Mediator-bound transcription preinitiation complex. Science, 372(6537), 52-56.
2、Rengachari, S., Schilbach, S., Aibara, S., Dienemann, C., & Cramer, P. (2021). Structure of human Mediator–RNA polymerase II pre-initiation complex. Nature, 1-8.
3、Chen, X., Qi, Y., Wu, Z., Wang, X., Li, J., Zhao, D., Hou, H., Li, Y., Yu, Z., Liu, W.,Wang, M., Ren, Y., Li, Z., Yang, H., and Xu, Y.* (2021). Structural insights into preinitiation complex assembly on core promoters. Science. 372(6541):eaba8490.
【非原创文章】本文著作权归文章作者所有,欢迎个人转发分享,未经允许禁止转载,作者拥有所有法定权利,违者必究。









 个人中心
个人中心
 我是园区
我是园区




