Science Signaling | 高分辨率SARS-CoV-2甲基转移酶结构揭示转录后加工分子机制
收藏
关键词:
揭示Science
资讯来源:医学权威 + 订阅账号
所属行业:疫苗 + 订阅行业
发布时间:
2020-10-07

截止2020年10月4日,全球新冠确诊病例已超过3500万,死亡病例100多万。面对严峻的疫情,多国研究者从不同角度开展了关于SARS-CoV-2的基础研究与临床试验。大多数研究集中于新冠病毒的结构蛋白与宿主受体、蛋白酶的相互作用,开放相应的抑制剂和中和抗体,对于病毒转录加工方面的认识相对较少。近日,美国西北大学Satchell团队利用X射线衍射解析了新冠病毒mRNA甲基转移酶nsp16与nsp10的复合体结构,深度解析了甲基转移酶的催化机理,为新冠病毒抑制剂的开发提供新的策略,相关研究成果发表在国际期刊Science Signaling上,题为“High-resolution structures of the SARS-CoV-2 2′-Omethyltransferase reveal strategies for structure-based inhibitor design”。
 标题
标题
冠状病毒为适应宿主系统,其RNA基因组具有典型的5’帽子和3’尾巴结构。病毒基因组能够以第一阅读框orf1和移码变体orf1ab翻译出多聚蛋白,在蛋白酶作用下加工为非结构蛋白质,参与形成复制转录复合体,另一方面又可以自身RNA作为模板合成亚基因组mRNA。冠状病毒mRNA合成类似于真核生物,其中关键的蛋白质是非结构蛋白nsp14和nsp16,首先N7甲基转移酶nsp14等病毒蛋白催化GpppN序列鸟嘌呤甲基化形成Cap0结构,接着在2’O甲基转移酶nsp16催化核糖甲基化修饰为Cap1结构,此外,nsp10对于nsp14和nsp16与RNA的结合起重要的稳定作用。转录后过程对于病毒逃逸宿主免疫至关重要。
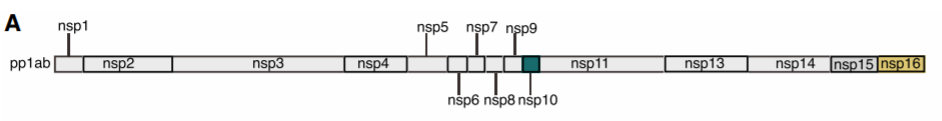
研究者首先表达纯化了新冠病毒nsp10和nsp16蛋白,在S-腺苷甲硫氨酸(SAM)存在下利用X衍射晶体学技术解析了不同状态下nsp16-nsp10共晶复合物。在第一个构象(小晶胞)中,nsp16-nsp10形成异源二聚体,甲基供体SAM结合nsp16,锌离子结合nsp10;而在第二种构象(大晶胞)中,两个二聚体形成了四聚体的不对称单元。通过结构比对,发现大晶胞与小晶胞除了nsp16 环区差异较大外,结构基本一致。利用尺寸排阻色谱法进一步证实了nsp16-nsp10结合比例。晶体结构表明nsp16 2'-O甲基转移酶活性中心具有罗斯曼折叠的超二级结构,而nsp10中心则是反平行β折叠结构,同时还具有锌指结构域,能够非特异性结合RNA。nsp16/10界面的残基表明氢键、疏水相互作用参与两个蛋白质结合作用。
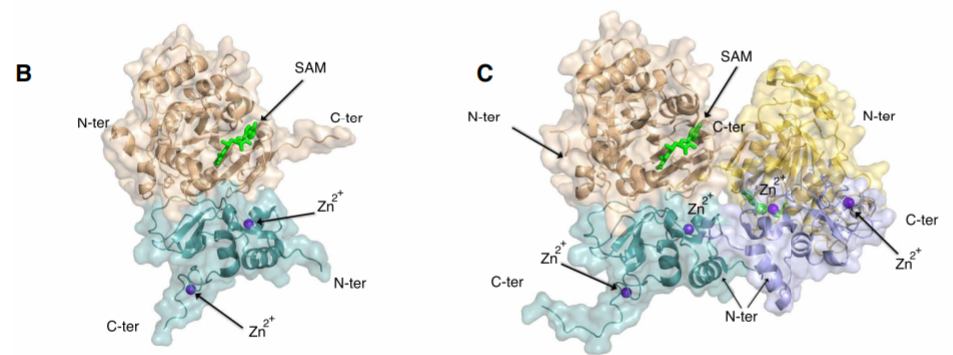
根据反应机理推测,nsp16能够催化SAM上的甲基转移到RNA Cap0结构上,生成S-腺苷高半胱氨酸(SAH)和Cap1结构,该反应可以被SAH的类似物SFG抑制。为了探究其中的分子机制,分别测定了不同复合体的结构,研究者观察到SAM能够结合到nsp16负电荷裂隙中,SAH、SFG与相同的残基作用但是不能进行结构修饰。
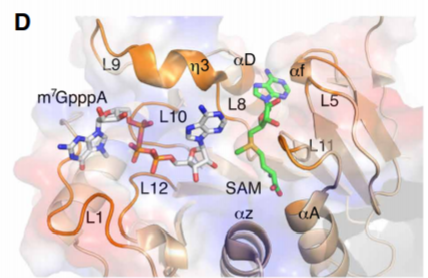
催化机制
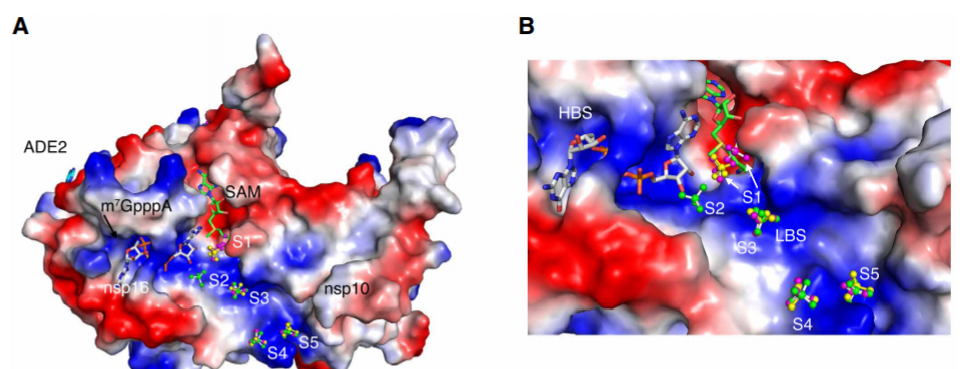
除了甲基供体外,nsp16催化还需要满足RNA1位为腺苷酸,因此研究者进一步分析了RNA m7GpppA与nsp16/10的结合机制,发现RNA上的腺苷酸能够与蛋白质的酪氨酸形成芳环堆积,使得RNA与SAM结合区更接近以便甲基转移。nsp16上的催化区域(KDKE)对于催化甲基转移SN2反应至关重要。同时研究者发现m7GpppA结合于nsp16的高亲和力位点,该区域可变性较大,m7 GpppA的结合能够使其从封闭构象转变为开放构象,释放甲基化产物。此外研究者还鉴定出nsp16其他RNA结合位点,可能也参与了转录后加工。
为了分析SARS-CoV-2与其他病毒的甲基转移酶差异,研究者又比较了SARS、MERS、SARS-CoV-2的nsp16/10结构,结果表明SARS-CoV和SARS-CoV-2的nsp16/10高度相似,但是在nsp16的环区中,SARS构象更为封闭,而新冠病毒的构象较为开放,这些都说明了冠状病毒甲基转移酶受到很强的正选择作用。
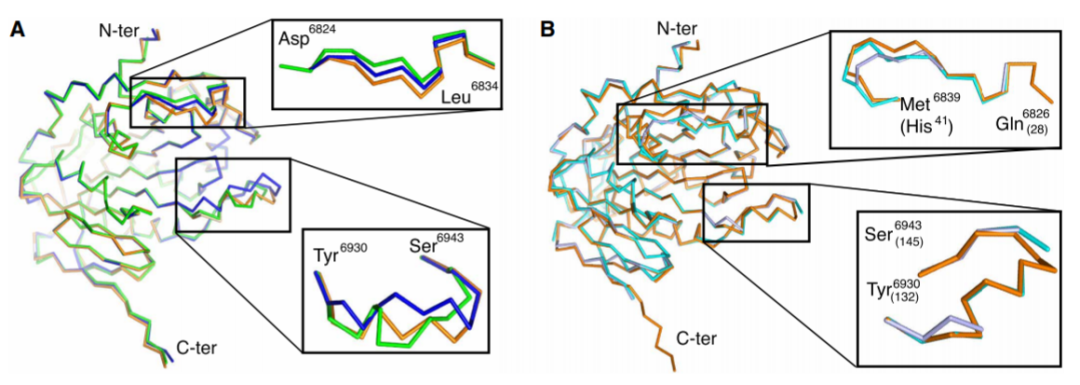
SARS、MERS、SARS-CoV-2 nsp16结构
该研究首次揭示了新冠病毒nsp16-nsp10复合体结构及其RNA修饰催化机理,为了解病毒的转录后加工提供结构基础。鉴于nsp16在冠状病毒中高度保守,且nsp16突变的毒株更容易被免疫系统清除,因此nsp16可能是一个良好的新冠病毒治疗靶点。设计小分子靶向nsp16/10界面可能有效阻断RNA甲基转移酶活性,激活干扰素应答信号通路,值得后续深入研究。
链接:https://stke.sciencemag.org/content/13/651/eabe1202


 标题
标题




 药选址
药选址
 标题
标题



