「 本文共:15条资讯,阅读时长约:3分钟 」




1.雅科CD7-CAR-T长期随访结果见刊。雅科生物CD7 CAR-T细胞治疗产品在《Journal of Hematology & Oncology》上公布治疗T细胞白血病患者的长期疗效数据。中位随访为27.0个月时,CD7 CAR-T细胞输注的总体反应率和完全缓解率分别为95%和85%;两年期无进展生存(PFS)率和总生存(OS)率分别为36.8%和42.3%,中位PFS和OS分别为11.0个月和18.3个月。治疗后30天内报告的不良事件包括3-4级细胞因子释放综合征(CRS;10%)和1-2级移植物抗宿主病(GVHD;60%)。
2.勃林格殷格翰IL-36R单抗拟纳入突破性品种。勃林格殷格翰IL-36单抗2.2类生物制品BI655130注射液(佩索利单抗)获CDE拟纳入突破性治疗品种,针对的适应症为预防泛发性脓疱性银屑病(GPP)发作。BI655130在Ⅱb期临床试验(EFFISAYIL 2)中达到主要和关键次要终点,能够避免青少年和成人GPP的发作长达48周。此前,该新药已在中国获批用于治疗成人GPP发作。
3.武田/大冢Bcr-Abl激酶抑制剂拟纳入优先审评。大冢制药与武田开发的第三代Bcr-Abl激酶抑制剂泊那替尼片(ponatinib,Iclusig)获CDE拟纳入优先审评,拟定适应症包括对既往用药耐药或不耐受的慢性髓性白血病(CML);复发或难治性费城染色体阳性急性淋巴细胞白血病(Ph+ALL);以及T315I阳性CML或T315I阳性Ph+ALL。一项5年随访数据显示,泊那替尼对于伴TKI耐药和(或)Bcr-AblT315I突变的各分期CML及Ph+ALL患者均具有良好的长期疗效。
4.上海君赛TIL细胞疗法早期临床积极。君赛生物自主研发的天然TIL细胞新药GC101治疗晚期实体肿瘤的Ⅰ期临床结果积极。数据分析显示,GC101的总体客观缓解率达到34.8%,其中3例患者获得CR疗效(完全缓解),已分别维持无瘤状态20个月、15个月与7个月。临床中未观察到剂量限制性毒性(DLT),安全耐受性良好。
5.泽璟FIC三抗获批实体瘤临床。泽璟生物及旗下子公司Gensun Biopharma开发的创新型生物制品注射用ZG006获FDA临床许可,拟开发用于小细胞肺癌和其它实体瘤的治疗。ZG006是一种针对CD3及两个不同DLL3表位的三特异性抗体,其抗DLL3端与肿瘤细胞表面不同DLL3表位相结合,抗CD3端结合T细胞。该产品能衔接肿瘤细胞和T细胞,将T细胞拉近肿瘤细胞,从而利用T细胞特异性杀伤肿瘤细胞。


1.甲状腺眼病疗法真实世界数据积极。Horizon公司胰岛素样生长因子1受体(IGF-1R)抑制剂Tepezza(teprotumumab)治疗甲状腺眼病(TED)的Ⅳ期临床达到主要终点。与安慰剂相比,Tepezza治疗组患者第24周时眼球突出度显著减少,两组患者眼球突出度较基线分别减少了2.41mm和0.92mm;两组患者眼球突出度改善≥2mm的比例分别有62%和25%。无论疾病活动度或持续时间如何,Tepezza的疗效以及安全性得到充分确认。
2.默沙东/Moderna癌症疫苗Ⅱ期研究积极。Moderna公司与默沙东联合开发的个体化mRNA癌症疫苗mRNA-4157联合PD-1抑制剂Keytruda辅助治疗完全切除后的高危黑色素瘤患者的Ⅱ期(mRNA-5157-P201/Keynote-942)试验最新结果即将公布于AACR2023年会上。去年年底,联合辅助治疗较Keytruda已显示出可降低患者44%(p=0.0266)的复发或死亡的风险。目前,这一组合疗法已向FDA递交加速批准上市申请。
3.Vivace公司TEAD抑制剂早期临床积极。Vivace公司TEAD抑制剂VT3989即将在AACR2023年会上公布用于患有恶性间皮瘤富集的晚期实体瘤和其他具有神经纤维瘤病2(NF2)突变的肿瘤患者中开展的首次人体Ⅰ期试验积极结果。VT3989旨在通过TEAD来抑制Hippo通路下游基因的转录和翻译,从而达到肿瘤治疗的目的。在EGFR突变的NSCLC患者来源的异种移植物模型中,VT3989提高了EGFR-TKI奥希替尼的疗效并增加疗效的持久性。
4.重组酶基因疗法治疗HTLV-1感染临床前研究积极。来自德国德累斯顿技术大学与PROVIREX基因编辑治疗公司等联合团队发表在《分子疗法》上的最新研究显示,他们开发的一种基于重组酶的基因编辑疗法,能够在临床前研究中将HTLV-1病毒从感染细胞的DNA中切除。这是一种与艾滋病毒相关的病毒,会引发白血病或无法治愈的脊髓疾病。
5.细胞治疗药物公司CTRL获千万美元融资。CTRL Therapeutics公司完成1000万美元种子轮融资,以推进其下一代细胞治疗平台,用于治疗实体肿瘤。CTRL公司专有的新一代技术能够从血液中提取循环肿瘤反应性淋巴细胞(cTRLs),有望解决现有细胞治疗技术的挑战。发布于Nature Biomedical Engineering期刊的研究显示,CTRL高通量细胞处理平台可以从血液中收集肿瘤反应性免疫细胞,在小鼠的实体肿瘤中具有显著的抗肿瘤活性。
6.2022年全球药品销售额TOP100出炉。根据各家制药公司财报披露的药品销售数据,2022年全球销售额超过10亿美元的重磅炸弹药物约160个,TOP100的上榜门槛是17.95亿美元,合计销售收入为4867.88亿美元。排位前十分别为:Comirnaty(辉瑞/BioNtech,378.06亿美元),Humira(艾伯维,212.37亿美元),Keytruda(默沙东,209.37亿美元),Paxlovid(辉瑞,189.33亿美元),Spikevax(Moderna,184.35亿美元),Eliquis(BMS/辉瑞,117.89亿美元),Biktarvy(吉利德,103.90亿美元),Revlimid(BMS,99.78亿美元),Stelara(强生,97.23亿美元),Eylea(再生元/拜耳,96.47亿美元)。


1.北京协和医院罕见病联合门诊开诊。4月10日,北京协和医院罕见病联合门诊正式开诊。来自心内科、肾内科、消化内科、血液内科、儿科、神经科的6位专家齐聚门诊,首日接诊29名罕见病患者,为罕见病患者提供更高效、更便捷的“组团式”诊疗服务。这是“以病人为中心”的学科群诊疗新模式再拓展,进一步压缩了诊治时间,节约了就医成本,提高了单元门诊效率。
2.复旦大学附属儿科医院奉贤院区建设项目获批。复旦大学附属儿科医院奉贤院区建设项目获国家卫健委批准。该工程总建筑面积112,875平方米,其中,地上建筑面积73,198平方米,地下建筑面积39,677平方米。工程概算总投资149,152万元,资金来源为安排中央预算内投资、上海市财政资金和上海市奉贤区财政资金共同解决。
3.上海市精卫中心成立“家委会”。上海市精神卫生中心近期成立“600号”暖心之家家委会。首届家委会委员共6位,来自医疗卫生、企业管理、文化建设、金融、教育等行业领域。“600号”暖心之家家委会将秉持“一切为了患者”理念,对患者体验相关工作提出意见和合理化建议,并将对医院各部门或员工给予监督、评议。


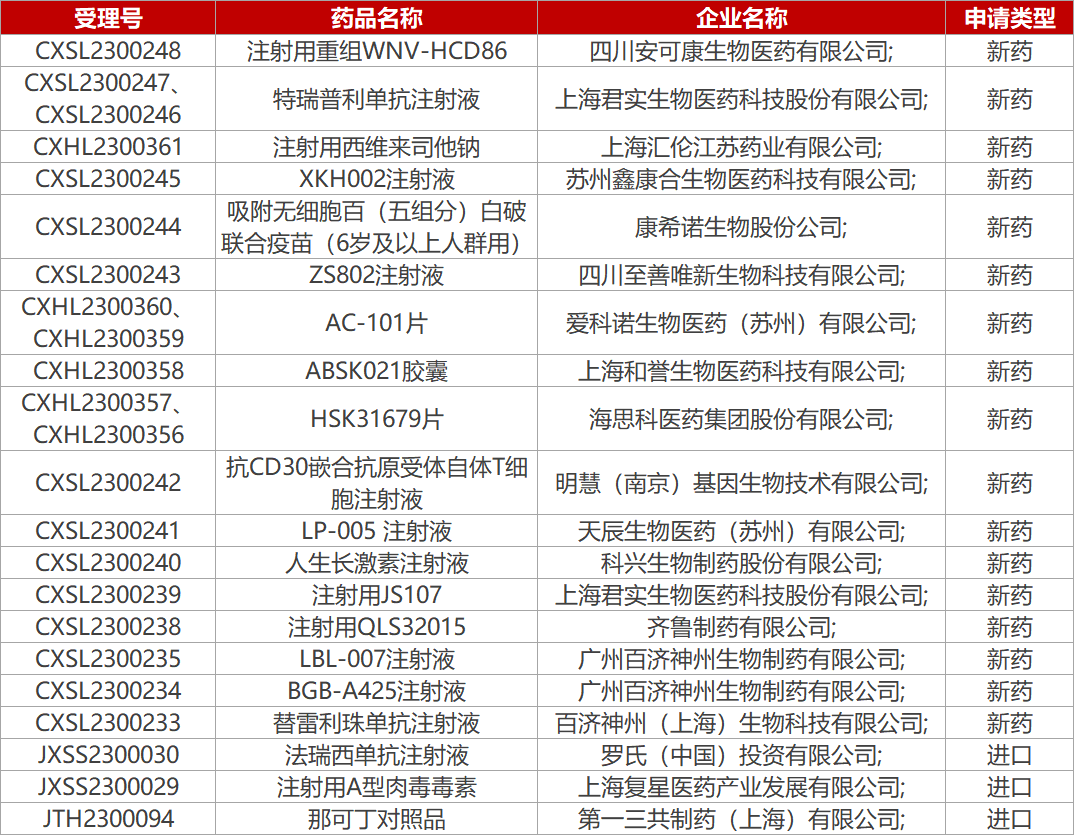
1. CDE新药受理情况(04月11日)



上个交易日 A 股医药板块 +0.36%
涨幅前三 跌幅前三
圣诺生物+11.85% 科美诊断-11.04%
西藏药业+10.00% 益方生物 -5.56%
C 海 森 +9.51% 首药控股 -5.46%
- The End -





 个人中心
个人中心
 我是园区
我是园区




